
【题目】室温下将a mL三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) / mol·L-1 | 混合溶液的pH |
甲 | c(HX)=0.1 mol·L-1 | 0.1 | pH = 10 |
乙 | c(HY)=0.1 mol·L-1 | 0.1 | pH = 7 |
丙 | c(HZ)=0.1 mol·L-1 | 0.1 | pH = 9 |
(1)根据表中数据比较HX、HY、HZ三种酸的酸性由强到弱的顺序为_________,丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-)= mol·L-1。
(2)部分实验反应过程中的pH变化曲线如下图:

①表示乙组实验的pH变化曲线是________________(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是________________。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性。
①浓度为1.0×10-3 mol·L-1的氨水b L
②c(OH-)=1.0×10-3 mol·L-1的氨水c L
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。则a、b、c、d的大小关系是_________________。
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是__________(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1__________m2(填“<”、“=”、“>”)
【答案】(1)HY>HZ>HX HZ+OH-=H2O+Z- 1×10-5
(2)①图1 ②B、E (3)b>a=d>c (4)B <
【解析】
试题分析:(1)由pH=10说明生成强碱弱酸盐,所以甲组实验说明HX是弱酸;乙组实验中由pH=7可以判断出溶液呈中性,也就是说生成的盐是强酸强碱盐,故HY为强酸;酸越弱生成的盐越容易水解,碱性越强,所以丙组实验说明酸性HZ大于HX,则HX、HY、HZ三种酸的酸性由强到弱的顺序为 HY>HZ>HX;丙组是实验中发生反应的离子方程式为HZ +OH-=H2O + Z-。由pH=9可知H+浓度为10-9,由于一部分氢离子和弱酸根离子结合了,故剩余的H+为10-9,则所得溶液中由水电离出的c(OH-) =10-5mol/L;
(2)①乙组溶液呈中性,故为图1;②表示溶液恰好完全反应的点有B,E。
(3)强酸强碱中和时生成的盐不水解,恰好反应时溶液显中性,则a=d;一水合氨是弱碱,存在电离平衡,与等浓度的氨水恰好反应时生成的盐水解显酸性,则要显碱性,氨水过量,即b>a=d;c(OH-)=1.0×10-3 mol·L-1的氨水浓度大于0.001mol/L,所以要使反应后溶液显中性,则氨水的体积要小于盐酸的,因此a、b、c、d的大小关系是b>a=d>c
(4)醋酸是一元弱酸,盐酸是一元强酸,在pH相等的条件下醋酸的浓度大于盐酸,与锌的反应过程中醋酸的电离平衡被破坏,向电离的方向进行,因此要使二者溶液的pH均升高到4,则醋酸消耗的锌,耗时也多,所以图中表示醋酸溶液中pH变化曲线的是B曲线;由于醋酸消耗的锌多,所以则m1<m2。


科目:高中化学 来源: 题型:
【题目】研究NOx、CO等大气污染物的测量及处理具有重要意义。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。NOx在催化转化器中被CO还原成N2排除。写出NO被CO还原的化学方程式:________________。
(2)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-905.5kJmol-1
4NO(g)+6H2O(g)△H=-905.5kJmol-1
N2(g)+O2(g)![]() 2NO(g)△H=+180kJmol-1
2NO(g)△H=+180kJmol-1
完成该方法中主要反应的热化学方程式
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=_________________。
4N2(g)+6H2O(g)△H=_________________。
②该方法应控制反应温度在315~400℃之间,反应温度过低会影响反应速率,但温度也不宜过高,原因是___________________。
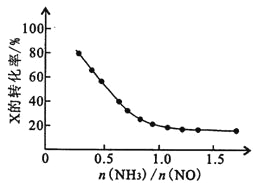
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如右图所示,则X是________________ (填化学式)。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是________________ 。
(3)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
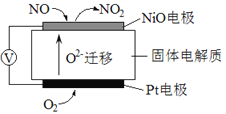
①Pt电极上发生的是______________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Q和R的摩尔质量之比是9:22,在反应X+2Y=2Q+R中,当1.6gX与Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量之比为
A.46:9
B.32:9
C.23:9
D.16:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中
A. 氧化产物与还原产物的物质的量之比为5:2
B. 氧化产物与还原产物的物质的量之比为2:5
C. 氧化剂与还原剂的物质的量之比为1:8
D. 氧化剂与还原剂的物质的量之比为5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为符合安全要求的是
A. 进入地下矿井中可用火把照明
B. 实验时将水倒入浓硫酸中配置稀硫酸
C. 节日期间,在开阔的广场燃放烟花爆竹
D. 在实验室可以用手接触药品,用嘴吹灭酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷中的碳原子是sp3杂化,下列用*表示碳原子的杂化和甲烷中的碳原子杂化状态一致的是 ( )
A. CH3*CH2CH3 B. *CH2=CHCH3 C. CH2=*CHCH2CH3 D. HC≡*CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年4月22日世界地球日的主题为“珍惜地球资源,转变发展方式——提高资源利用效益”。下列说法不符合该主题的是( )
A. 利用农作物秸秆制取乙醇
B. 回收地沟油,制备生物柴油
C. 焚烧废旧塑料,防止白色污染
D. 开发利用各种新能源,减少对化石燃料的依赖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com