实验室欲配制0.5mol/L的NaOH溶液500mL,有以下仪器:
①烧杯 ②玻璃棒 ③托盘天平(带砝码) ④药匙,
按要求填空:
(1)配制时,需称取NaOH的质量是______g,还缺少的仪器是______.
(2)使用容量瓶前必须进行的一步操作是______.
(3)在配制过程中,其他操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是______.(选填序号)
①没有洗涤烧杯和玻璃棒 ②未等NaOH溶液冷却至室温就转移到容量中
③容量瓶不干燥,含有少量蒸馏水 ④定容时仰视标线 ⑤定容时俯视标线.
解:(1)m=CVM=0.5mol/L×0.5L×40g/mol=10.0g,还需要的仪器是:用于配制溶液的500mL容量瓶,用于定容的胶头滴管,故答案为:10.0;胶头滴管、500 mL容量瓶;
(2)容量瓶在使用前要进行检漏,故答案为:检查容量瓶是否漏液;
(3)根据c=

分析误差,如果n偏大或V偏小,则配制溶液浓度偏高,
①没有洗涤烧杯和玻璃棒导致溶质的物质的量减小,配制溶液浓度偏低;
②未等NaOH溶液冷却至室温就转移到容量中,导致溶液体积偏小,配制溶液浓度偏大;
③容量瓶不干燥,含有少量蒸馏水,溶质的物质的量和溶液的体积都不变,所以配制溶液浓度不变;
④定容时仰视标线,导致溶液体积偏大,配制溶液浓度偏低;
⑤定容时俯视标线,导致溶液体积偏小,配制溶液浓度偏高;
故选②⑤.
分析:(1)根据m=CVM计算氢氧化钠的质量,根据仪器的作用选取仪器;
(2)容量瓶在使用前要进行检漏;
(3)根据c=

分析误差,如果n偏大或V偏小,则配制溶液浓度偏高.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,会根据c=

分析误差,为易错点.

 分析误差,如果n偏大或V偏小,则配制溶液浓度偏高,
分析误差,如果n偏大或V偏小,则配制溶液浓度偏高, 分析误差,如果n偏大或V偏小,则配制溶液浓度偏高.
分析误差,如果n偏大或V偏小,则配制溶液浓度偏高. 分析误差,为易错点.
分析误差,为易错点. 

 阅读快车系列答案
阅读快车系列答案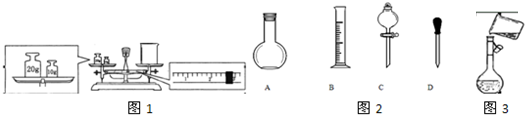
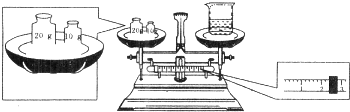 实验室欲配制0.5mol/LNaOH溶液500mL.
实验室欲配制0.5mol/LNaOH溶液500mL.