
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
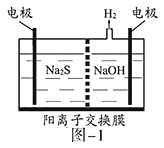
(1)将烧碱吸收H2S后的溶液加入到如题图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-=S(n—1)S+ S2-=Sn2-。
①写出电解时阴极的电极反应式:__________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_____________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题图—2所示。
①在图示的转化中,化合价不变的元素是___________。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为_______________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有___________________。
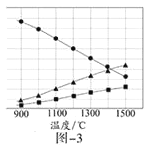
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题图—3所示,H2S在高温下分解反应的化学方程式为_____________。

【答案】2H2O+2e-=H2↑+2OH- Sn2-+2H+=(n-1)S↓+H2S↑ Cu、H、Cl 0.5 mol 提高空气的比例(增加氧气的通入量) 2H2S![]() 2H2+S2
2H2+S2
【解析】
(1)①阳极上硫离子放电,电极反应式为S2--2e-=S,阴极上氢离子放电生成氢气,电极反应式为2H2O+2e-=H2↑+2OH-,故答案为2H2O+2e-=H2↑+2OH-;
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故答案为Sn2-+2H+=(n-1)S↓+H2S↑;
(2)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,故答案为Cu、H、Cl;
②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,消耗O2的物质的量=![]() =0.5mol,故答案为0.5mol;
=0.5mol,故答案为0.5mol;
③欲使生成的硫单质中不含CuS,则硫离子不能剩余,即硫离子完全被氧化为S单质,所以氧气必须过量,采取的措施为提高混合气体中空气的比例,故答案为提高混合气体中空气的比例;
(3)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,所以该反应方程式为2H2S![]() 2H2+S2,故答案为2H2S
2H2+S2,故答案为2H2S![]() 2H2+S2。
2H2+S2。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
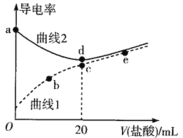
下列说法正确的是
A.曲线1代表四甲基氢氧化铵溶液
B.常温下,CH3NH3Cl水解常数的数量级为10-11
C.b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D.在b、c、e三点中,水的电离程度最大的点是e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;②Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-。
回答下列问题:
Ⅰ.甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为_______(填“正确”或“不正确”),理由是___________________________________。
Ⅱ.乙同学为测定草酸亚铁晶体FeC2O4﹒xH2O中的结晶水含量,利用如下装置:
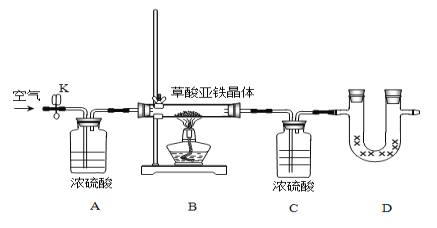
①做实验前首先要_____________________________;
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤依次为____________________,重复实验直至B中恒重。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入空气 e.冷却至室温 f.称量
Ⅲ.丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a克草酸亚铁晶体溶入稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c mol/L的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式_____________________
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有__________
(3)x=_______________
(4)若实验中滴入KMnO4溶液过多,则所得x值___________(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g) N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4 和1.2mol NO2,测得不同温度下 n(CH4)随时间变化的有关实验数据如表所示,下列说法正确的是
组别 | 温度/K | 时间/min 物质的量/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | M | 0.15 |
A.由实验数据可知温度 T 1<T2
B.组别①中 0 ~20 min 内,NO2 降解速率为0.0125 molL-1min-1
C.40 min 时,表格中 M 对应的数据为 0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是
A. Cu与浓HNO3―→Cu(NO3)2
B. Cu与稀HNO3―→Cu(NO3)2
C. Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D. Cu+AgNO3―→Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
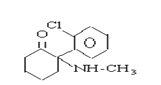
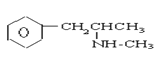
氯胺酮(K粉) 冰毒
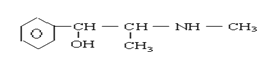
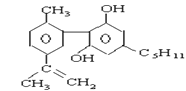
摇头丸 大麻
A.K粉的分子式为C13H16ClNO
B.这四种毒品都属于芳香烃
C.1mol大麻最多可与含4mol Br2的浓溴水发生反应
D.摇头丸不可能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为114号的稳定同位素![]() X预测。
X预测。
(1)114X元素位于元素周期表第________周期____族,为________元素(“金属”、“非金属”)。
(2)其最高价氧化物及其对应水化物的分子式分别是____、____(用含X的式子表示),并估计后者为_______性(酸碱、两性)。
(3)它与氯生成化合物的分子式________、________(用含X的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是______(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体的结构式:_______;C、N、O的电负性由大到小的顺序为______(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们简单氢化物的沸点从高到低的顺序为______,其原因为______。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价, [Cu(NH3)2]+中中心离子的电子排布式为______,其中碳原子的杂化轨道类型是______,NH3分子的VSEPR模型为______。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
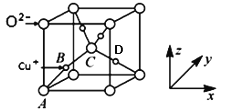
①若以A点为原点建立坐标系,A的坐标为(0,0,0),B的坐标为(![]() ),则D的坐标为______;
),则D的坐标为______;
②若阿伏加德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx之间的转化具有重要意义。
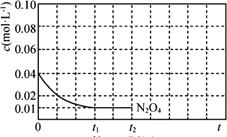
(1)已知:N2O4(g) ![]() 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是________。
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变 D.容器内气体的密度不变 E.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
2NO2(g)的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线________。
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。
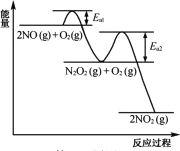
Ⅰ 2NO(g)=N2O2(g) ΔH1
Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com