
|
��֪��H+����Һ����ˮ�������ӵ���ʽ���ڣ�H+��H2O ��2Na��2NH3 ��CaO��2NH4Cl ��3Mg(NH2)2 ��NH4Cl��NaNH2 | |
A�� |
�� |
B�� |
�� |
C�� |
�ڢ� |
D�� |
�٢ڢۢ� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| +4 |
| Xe |
| +6 |
| Xe |
| +6 |
| Xe |
| c(H+)��c(F-) |
| c(HF) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��16�֣�����һ����Ҫ�Ļ���ԭ�ϣ����ĺϳɺ�Ӧ���ǵ�ǰ����Ҫ�о�����֮һ��
(1)һ�������£���һ���ܱ������г������壺N2 2mol��H2 6mol����ƽ���N2��ת����Ϊ50%��ͬʱ����92.3KJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��______________________________��
(2)��ͳ�������ϳɰ���������صķ�ӦʽΪ��N2+3H22NH3 ��
�ٸ÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ��K=______________�������¶ȣ�Kֵ______���������С�����䡱����
�ڲ�ͬ�¶ȡ�ѹǿ�£��ϳɰ�ƽ����ϵ��NH3�����ʵ����������±���N2��H2����ʼ���ʵ���֮��Ϊ1��3���������������ݣ� �����¶Ⱥ�ѹǿ����ʱH2ת������ߣ�ʵ�ʹ�ҵ�����в�ѡ�ø���������Ҫԭ���� ��
�����й��ںϳɰ�˵����ȷ�� ������ĸ��
A��ʹ�ô���������ߵ�����ת����
B��Ѱ�ҳ����µĺ��ʴ�����δ���о��ķ���
C�����ڦ�H<0����S>0���ʺϳɰ���Ӧһ�����Է�����
(3)�������Simons�ȿ�ѧ�ҷ����˲���ʹ�����ѻ�Ϊ��Ϳ�ֱ������ȼ�ϵ�صķ�������װ��Ϊ�ò�����Ϊ�缫������������Һ�У�һ���缫ͨ���������һ�缫ͨ�백�������ط�ӦΪ4NH3+3O2=2N2+6H2O������Ϊ�������ҺӦ�� ��(����ԡ���������"�������ԡ�)��д�������缫��Ӧʽ ��
(4)��ҵ�Ͼ�����������Ⱦ����֮һ�ǣ�����K2Cr2O7���Է�ˮ��������ڣ�����������NaCl����Fe��ʯīΪ�缫���е�⡣����һ��ʱ�������Cr(OH)3��Fe(OH)3������ȥ����֪Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31����
��֪�������Һ��c(Fe3+)Ϊ2.0��10-13mol/L������Һ��c(Cr3+)Ϊ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡЭ���������һ���������ۻ�ѧ�Ծ��������棩 ���ͣ������
Ԫ�ؼ��仯�����������������о��й㷺����;��
��.����ѧ�ḻ���.
��1���ڳ����£����ܻ�����ϡ���ᷴӦ��������ɫ��Һ�� ��ͭ��ȣ������������?????? ������ǿ��������������
��Cr( OH)3��Al( OH)3���ƣ�Ҳ���������������ˮ�д�����ʽ�ͼ�ʽ����ƽ�⣬����ʽ���뷽��ʽ��?????????????????????????? ��
����ҵ�Ͼ�����������Ⱦ����֮һ�ǣ�����K2Cr2O7���Է�ˮ���˵����ڣ�����������NaCl����Fe��ʯīΪ�缫���е�⡣����һ��ʱ�������Cr(OH)3��Fe(OH)3������ȥ(��֪KsP[ Fe(OH)3]=4.0��10-38��KsP[Cr(OH)3]=6.0��l0-31)����֪�������Һ��c( Fe3+)Ϊ2.0��10��13mol/L������Һ��c(Cr3+)Ϊ??????????? mol/L��
��.����A��H����ͼ��ʾת����ϵ(����������δ�г�)��A��E��F��G��Ϊ���壬DΪ�������ʡ�

��ش��������⣺
��1��A�ĵ���ʽΪ???????? D�Ļ�ѧʽ?????????? ��C��Һ��������??????????????????? ��
��2����Ӧ���Ļ�ѧ����ʽΪ?????????????????????????????? ��
��Ӧ�������ӷ���ʽΪ?????????????????????????????????? ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ����3���¿����۲��֣������棩 ���ͣ������
��16�֣�����һ����Ҫ�Ļ���ԭ�ϣ����ĺϳɺ�Ӧ���ǵ�ǰ����Ҫ�о�����֮һ��
(1)һ�������£���һ���ܱ������г������壺N2 2mol��H2 6mol����ƽ���N2��ת����Ϊ50%��ͬʱ����92.3KJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��______________________________��
(2)��ͳ�������ϳɰ���������صķ�ӦʽΪ��N2+3H2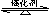 2NH3 ��
2NH3 ��
�ٸ÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ��K=______________�������¶ȣ�Kֵ______���������С�����䡱����
�ڲ�ͬ�¶ȡ�ѹǿ�£��ϳɰ�ƽ����ϵ��NH3�����ʵ����������±���N2��H2����ʼ���ʵ���֮��Ϊ1��3���������������ݣ� �����¶Ⱥ�ѹǿ����ʱH2ת������ߣ�ʵ�ʹ�ҵ�����в�ѡ�ø���������Ҫԭ���� ��

�����й��ںϳɰ�˵����ȷ�� ������ĸ��
A��ʹ�ô���������ߵ�����ת����
B��Ѱ�ҳ����µĺ��ʴ�����δ���о��ķ���
C�����ڦ�H<0����S>0���ʺϳɰ���Ӧһ�����Է�����
(3)�������Simons�ȿ�ѧ�ҷ����˲���ʹ�����ѻ�Ϊ��Ϳ�ֱ������ȼ�ϵ�صķ�������װ��Ϊ�ò�����Ϊ�缫������������Һ�У�һ���缫ͨ���������һ�缫ͨ�백�������ط�ӦΪ4NH3+3O2=2N2+6H2O������Ϊ�������ҺӦ�� ��(����ԡ���������"�������ԡ�)��д�������缫��Ӧʽ ��
(4)��ҵ�Ͼ�����������Ⱦ����֮һ�ǣ�����K2Cr2O7���Է�ˮ��������ڣ�����������NaCl����Fe��ʯīΪ�缫���е�⡣����һ��ʱ�������Cr(OH)3��Fe(OH)3������ȥ����֪Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31����
��֪�������Һ��c(Fe3+)Ϊ2.0��10-13mol/L������Һ��c(Cr3+)Ϊ mol/L��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com