
| A、②⑤⑥ | B、①③⑥ |
| C、②④⑤ | D、①②④ |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:

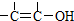 结构的物质不能稳定存在.
结构的物质不能稳定存在.查看答案和解析>>
科目:高中化学 来源: 题型:
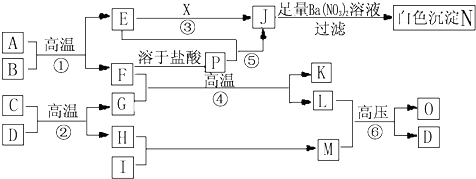
查看答案和解析>>
科目:高中化学 来源: 题型:
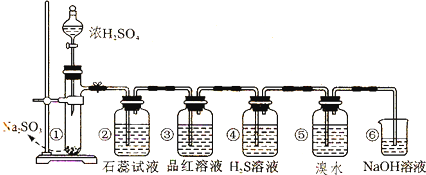
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.0 g重水(D2O)中含有的质子数和中子数都为1.0 NA |
| B、pH>7的溶液中:Na+、K+、CO32-、ClO一、S2-不能大量共存 |
| C、向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D、酒精溶于水时没有破坏化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
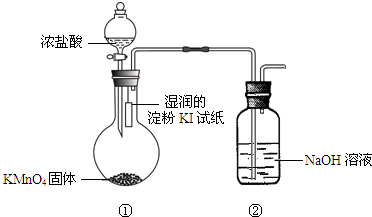 欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).
欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠、镁、铝化学性质活泼,均须密封保存 |
| B、酸式滴定管注入Na2CO3溶液之前应检查是否漏液 |
| C、可用玻璃棒蘸少量待测物质的浓溶液做焰色反应 |
| D、可用盐酸清洗长期存放三氯化铁溶液的试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中各离子浓度为:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | ||||||
B、②升高温度,
| ||||||
| C、③加入等体积的水稀释,电离平衡正向移动,c(H+)增大 | ||||||
| D、③和④等体积混合后溶液的pH<7,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com