
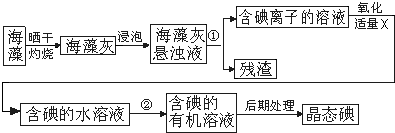
分析 (1)分离固体和液体用过滤,利用溶解性的差异来分析;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,据此来选择合适的试剂;
(3)加入的氧化剂能将碘离子氧化为碘单质,同时不引入新杂质;
(4)从有机溶液中提取碘,需要蒸馏操作.
解答 解:(1)过滤适用于不溶于水的固体和液体,分离固体和液体用过滤;将碘水中的碘单质萃取出来,选择合适的萃取剂即可,故答案为:过滤;萃取和分液;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,
故答案为:苯与水互不相溶,碘在苯中的溶解度比在水中的大;
(3)加入的氧化剂能将碘离子氧化为碘单质,同时不引入新杂质,过氧化氢是绿色氧化剂,在氧化过程中不引入新的杂质,不产生污染(不会进一步氧化单质碘),故答案为:过氧化氢是绿色氧化剂,在氧化过程中不引入新的杂质,不产生污染(不会进一步氧化单质碘);
(4)从有机溶液中提取碘,需要蒸馏操作,需要的玻璃仪器有温度计、冷凝器、接液管、锥形瓶,故答案为:蒸馏;BDEF.
点评 本题考查了物质的分离和提纯,掌握过滤、萃取、蒸馏等操作是解答本题的关键,题目难度不大.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
| A. | 是11或15 | B. | 只能是15 | C. | 只能是7 | D. | 只能是11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物都能与醋酸发生酯化反应 | |
| B. | 除饱和烃之外的其他烃都能发生聚合反应 | |
| C. | 醇类、卤代烃都能发生消去反应 | |
| D. | 氨基酸、乙酸和苯酚都能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
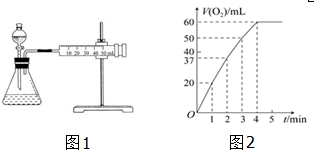
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
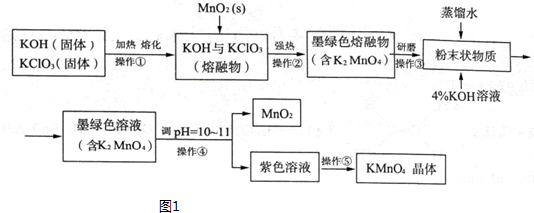
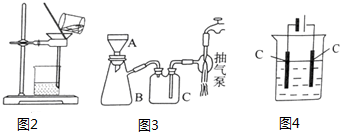
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com