
����Ŀ��(1)25���£���ˮ��c(H��)��1��10��7 mol��L��1�����ʱc(OH��)��______________�����¶�����ˮ�м����ᣬʹ��Һ�е�c(H��)��1��10��3 mol��L��1�����ʱ��Һ��pH��_______________����25���£���ˮ�м���NaOH���壬ʹ��Һ��pH��13����ʱ��Һ��c(OH��)��___________�� �봿ˮ�ĵ������ƣ�Һ����Ҳ���������ĵ��룺2NH3 ![]() NH4+��NH2������д��Һ���ĵ���ƽ�ⳣ������ʽK =____________________________��
NH4+��NH2������д��Һ���ĵ���ƽ�ⳣ������ʽK =____________________________��
(2)ͬ���������ת���ķ�Ӧ���൱�ٶ�ת������������ʱ���ܲ���ȫ���ⶨʱ�� ���ѣ��ֿ����ݸ�˹���ɽ��м��㡣��֪��
P4 (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H1 ����283.2 kJ��mol��1 ��
4P (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H2 ����184.0kJ��mol��1 ��
���Ȼ�ѧ����ʽ���������ȶ�����ͬ���������� ______(��������������������) ����д������ת���ɺ����Ȼ�ѧ����ʽ______________________________________��
���𰸡�1��10��7 mol��L��1 3 1��10��1mol��L��1��0.1mol��L��1 K = ���� P4 (���ף�s)��4P (���ף�s) ��H1 ����99.2 kJ��mol��1
���� P4 (���ף�s)��4P (���ף�s) ��H1 ����99.2 kJ��mol��1
��������
(1)25���£���ˮ��c(H��)��1��10��7 mol��L��1�����ʱc(OH��)��c(H��)��1��10��7 mol��L��1;
���¶�����ˮ�м����ᣬʹ��Һ�е�c(H��)��1��10��3 mol��L��1�����ʱ��Һ��pH��-lgc(H��)��=-lg10��3=3��
��25���£���ˮ�м���NaOH���壬ʹ��Һ��pH��13����ʱ��Һ��c(OH��)��![]() 0.1mol��L��1��
0.1mol��L��1��
�봿ˮ�ĵ������ƣ�Һ����Ҳ���������ĵ��룺2NH3 ![]() NH4+��NH2�������ݵ���ƽ�ⳣ���Ķ��壬Һ���ĵ���ƽ�ⳣ������ʽK =
NH4+��NH2�������ݵ���ƽ�ⳣ���Ķ��壬Һ���ĵ���ƽ�ⳣ������ʽK = ��
��
(2)���ݸ�˹���ɽ��м��㡣��֪��
P4 (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H1 ����283.2 kJ��mol��1 ��
4P (���ף�s) �� 5O2 (g) �� 2P2O5 (s)�� ��H2 ����184.0kJ��mol��1 ��
��-�ڵã�P4 (���ף�s)=4P (���ף�s)��H=��283.2 kJ��mol��1 +184.0kJ��mol��1=-99.2kJ��mol��1�����Ȼ�ѧ����ʽ���������ȶ�����ͬ���������Ǻ��ס�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ 2AB3(g) ![]() A2(g) �� 3B2(g) ; ��H��0������ͼ����ȷ����
A2(g) �� 3B2(g) ; ��H��0������ͼ����ȷ����
A. B.
B.
C. D.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pOH=-lgc(OH-)�������£���ϡ����μӵ�ijһԪ�BOH����Һ�У���û����Һ��pOH ����Ũ�ȵı仯��ϵ��ͼ��ʾ�� ����˵���������(����)
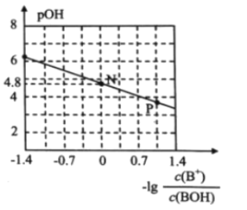
A.����0.1mol/L BOH��Һ�м�ˮϡ�ͣ�����Һ��c(OH-)/c(BOH) ����
B.�����£�BOH�ĵ���ƽ�ⳣ��K = 1��10-4.8
C.P����ʾ����Һ�У�c(Cl-) > c(B+)
D.N����ʾ����Һ�У� c(H+) = c(Cl-) + c(OH-) - c(BOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����ڵ��뷽��ʽ����(����)��
A.2H2O ![]() H3O����OH��B.CH3COOH��H2O
H3O����OH��B.CH3COOH��H2O ![]() CH3COO����H3O��
CH3COO����H3O��
C.H2CO3![]() H����HCO3��D.CH3COOH��NaOH = CH3COONa��H2O
H����HCO3��D.CH3COOH��NaOH = CH3COONa��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ʴ��ÿ����ʴ����ʧ�ĸֲ�ռ���������������ķ�֮һ��
(1)������ʴ��Ҫ��������ʴ���ø�ʴ�����еĵ缫��ӦʽΪ��������_____________________________ ��������______________________��
(2)Ϊ�˽���ijˮ����բ�ű���ʴ�����ʣ����Բ��ü�ͼ��ʾ�ķ��������к�����բ ���ϵĹ������R���Բ���___________��
A��ͭ B���� C��п D��ʯī
(3)��ͼ��ʾ�ķ���Ҳ���Խ�����բ�ŵĸ�ʴ���ʣ�������բ��Ӧ��������ֱ����Դ��___________����

(4)Ǧ�����ǻ�ѧ��Դ����缫���Ϸֱ�ΪPb��PbO2���������ҺΪϡ���ᣬ�ŵ�ʱ��ص��ܷ�ӦΪPb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O��������������жϣ�
��Ǧ���ص�����������_______(����Pb������PbO2��)�������ĵ缫��ӦʽΪ_______________________________________��
��Ǧ���ع���ʱ���������Һ��SO42������________��(����������������)����Һ��pH___________ (��������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���������ͬ��������Һ����pH=3��CH3COOH��Һ ��pH=3������ ��pH=11�İ�ˮ ��pH=11��NaOH��Һ������˵������ȷ������ ��
A. ����������Һϡ��100����ϡ�ͺ���ҺpH��С˳��>��>��>��
B. ������Ģں͢ۻ������ǿ�������Σ���Ϻ���Һ������
C. ������Ģۺֱܷ͢��õ�Ũ�ȵ�������Һ�кͣ�����������Һ���������>��
D. ������Ģٺ͢ڷֱ���������п����Ӧ���ɵ�������ͬ��ͬѹ���������>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�̼������ϳ�ȼ���ǽ����ԴΣ������Ҫ��������֪CO(g)��2H2(g)![]() CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��
CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ� ��

A.�÷�Ӧ����H����91 kJ��mol��1
B.����������÷�Ӧ����H��С
C.��Ӧ��������������������������
D.����÷�Ӧ����Һ̬CH3OH������H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڣ��������ij�ܱ������з����ϳɰ���Ӧ��N2(g)��3H2(g) ![]() 2NH3(g) ��H<0��673K��30MPa�£�n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
2NH3(g) ��H<0��673K��30MPa�£�n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ� ��
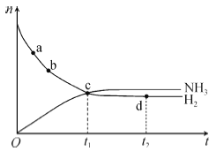
A.a�������Ӧ���ʴ���b���
B.c�㴦������(N2)������(N2)
C.d�㴦������(N2)������(H2)��1��3
D.�����¶ȣ���Ӧ��t2ʱ�̣�n(H2)��ͼ��d���ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ʹCH3COONa��Һ��Na����Ũ����CH3COO����Ũ�ȱ�Ϊ1��1������CH3COONa��Һ�м���( )
������������ ��������NaCl �������Ĵ��� ��������CH3COONa
A���٢� B����
C���ۢ� D����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com