
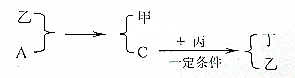
分析 因A、B、C、D为四种气体单质,一般常见的气体单质有H2、N2、O2、F2、Cl2等,B可以分别跟单质A、C、D化合生成的甲、乙、丙每个分子中含有10个电子,化合物可能是HF、NH3、H2O,可推测B为H2,再根据气体单质A和化合物乙反应生成化合物甲和气体单质C,故可推测A为F2,乙为H2O,甲为HF,C为O2,由框图关系进一步推测丙为NH3,丁为NO,D为N2,均符合题意,以此解答该题.
解答 解:因A、B、C、D为四种气体单质,一般常见的气体单质有H2、N2、O2、F2、Cl2等,B可以分别跟单质A、C、D化合生成的甲、乙、丙每个分子中含有10个电子,化合物可能是HF、NH3、H2O,可推测B为H2,再根据气体单质A和化合物乙反应生成化合物甲和气体单质C,故可推测A为F2,乙为H2O,甲为HF,C为O2,由框图关系进一步推测丙为NH3,丁为NO,D为N2,均符合题意.
(1)由上述分析可知,化合物丙为NH3,故答案为:NH3;
(2)单质A与化合物乙反应的化学方程式为:2F2+2H2O=4HF+O2;
氨气和氧气在催化剂作用下反应生成NO和水,高于方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:2F2+2H2O=4HF+O2;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)氨气中N元素化合价为-3,NO中N元素化合价为+2,由氧化还原反应可知二者可能发生反应可生成氮气和水,反应方程式为:4NH3+6NO=5N2+6H2O,故答案为:能.
点评 本题考查无机物的推断,气体单质及10电子物质为推断突破口,注意掌握物质的性质以及转化关系,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 原子半径:Br<Cl<F | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | D. | 沸点:乙酸>乙醇>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体粒数为0.1NA | |
| B. | 46gNO2和N2O4的混合气体中含N原子总数为NA | |
| C. | 标准状况下,5.6LCCl4含有的分子数为0.25NA | |
| D. | 0.25molNa2O2中含有的阴离子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | (NH4)2SO4 | C. | NH3•H2O | D. | NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10%的H2SO4溶液 | B. | NaCl | ||
| C. | 碱石灰(固体,含NaOH,CaO) | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl-,Mg2+,K+,SO42- | B. | NH4+,Cl-,Na+,Ba2+ | ||
| C. | Fe2+,NO3-,Cl-,Na+ | D. | HCO3-,K+,NH4+,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列关于此电池说法正确的是( )| A. | 充电过程中,当0.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子 | |
| B. | 电池放电时,负极反应为:3NaBr一2e-═NaBr3+2Na+ | |
| C. | 充电过程中钠离子从右到左通过离子交换膜 | |
| D. | 放电过程中钠离子从左到右通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com