
【题目】合成氨在生产中具有重要意义。请按要求回答下列问题。
(1)已知反应N2(g)+3H2(g)![]() 2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1molN2、3molH2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1molN2、3molH2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
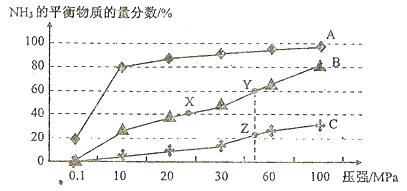
①曲线A、B、C对应的温度是由低到高依次是(填代表曲线的字母)_______。图中X、Y、Z点的平衡常数大小关系(填“>”“<”或“=”):K(X)__K(Y)_____K(Z).
②既能加快化学反应速率有能提高H2的转化率的措施有_______。
③Y点对应的H2的转化率是_______;若仅将起始投料均加倍,其他条件不变,达新平衡时,则H2的转化率将会(填“升高”、“降低”或“不变”) _______ 。
(2)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图甲和图乙所示:
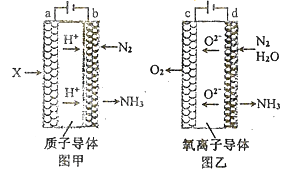
①图甲a电极上的电极反应式为_______图乙d电极上的电极反应式为_______。
②若图甲和图乙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______。
【答案】 A<B<C = > 加压或增大N2的浓度 75% 升高 H2-2e-=2H+ N2+3H2O+6e-=2NH3+3O2- 4:3
【解析】(1)因为正反应是吸热反应,相同压强下,投料相同升高温度平衡逆向移动,氨气的含量减小,所以①曲线A、B、C对应的温度是由低到高依次是. A<B<C。因为K只受温度影响,温度不变,化学反应平衡常数不变,图中X、Y在同一条曲线上所以平衡常数相等,Z点氨的转化率低,所以温度高,因为正反应是吸热反应,所以升高温度平衡逆向移动,平衡常数降低,所以X、Y、Z点的平衡常数大小关系K(X)=K(Y)>K(Z)。
②加快化学反应速率的因素是升高温度,增大压强、提高浓度,加催化剂;要提高H2的转化率需要化学平衡正向移动,结合两方面因素,可采取的措施有加压或增大N2的浓度。
③根据反应: N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
初始量(mol) 1 3 0
变化量(mol) x 3x 2x
Y点量(mol)1-x 3-3x 2x
Y点时氨气的质量分数为60%,所以[2x/(1-x+3-3x +2x)]![]() 100%=60% x=0.75mol,Y点对应的H2的转化率是为[(3
100%=60% x=0.75mol,Y点对应的H2的转化率是为[(3![]() 0.75mol)/3mol]
0.75mol)/3mol]![]() 100%=75%。若仅将起始投料均加倍,增大压强平衡正向移动,所以在其他条件不变,增加起始投料达新平衡时,则H2的转化率将升高。答案:75% 升高。
100%=75%。若仅将起始投料均加倍,增大压强平衡正向移动,所以在其他条件不变,增加起始投料达新平衡时,则H2的转化率将升高。答案:75% 升高。
(2)①根据图示甲可知电解时a为阳极,氢气在阳极放电生成氢离子,电极反应式为;H2-2e-=2H+,据图示乙可知电解时d电极为阴极,氮气和水在阴极放电生成氨气和O2-,电极反应式为:N2+3H2O+6e-=2NH3+3O2-;
②图甲中阴极电极反应式为:N2+6e-+6H+=2NH3,图乙中阴极电极反应式为:N2+3H2O+6e-= 2NH3+3O2-,生成1mol氨气,反应均转移3mol电子,则通电时间相同、电流强度相等,电解效率分别为80%和60%时,图甲和图乙装置生成的氨气的物质的量之比1×80%:1×60%=4:3。


科目:高中化学 来源: 题型:
【题目】(1)如图为CO2分子晶体结构的一部分,观察图形。试说明每个 CO2分子周围有________个与之紧邻且等距的 CO2分子;该结构单元平均占有________个CO2分子。

(2)在40 GPa高压下,用激光器加热到1800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是________。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4 mol C—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量__________溶解,再向该溶液中加入适量的__________溶液,如有____________现象产生,则证明产物中存在Fe2O3
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为_______________(填装置序号)
②实验中如观察到装置A中品红溶液______,装置B BaCl2溶液中__________,则可证明FeSO4高温分解产生的气体中含有SO2、SO3。
③装置C中NaOH溶液的作用是_______________(用离子方程式表示〕。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时消耗2nmolNO2
②单位时间内生成nmolO2的同时消耗2nmolNO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的说法中正确的是( )
A.不能发生丁达尔效应的分散系有氯化钠溶液、水等
B.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康的危害更大
C.胶体的分散质粒子的直径为1~10 nm
D.氯化铁溶液与氢氧化铁胶体的本质区别是有无丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应,属于氧化还原反应的是( )
A. CaCO3![]() CaO + CO2 ↑ B. 2NaOH +CO2
CaO + CO2 ↑ B. 2NaOH +CO2![]() Na2CO3+ H2O
Na2CO3+ H2O
C. NaOH+HCl==NaCl+H2O D. 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com