
| A. | 酚酞溶液 | B. | HCl溶液 | C. | BaCl2溶液 | D. | Ba(OH)2溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
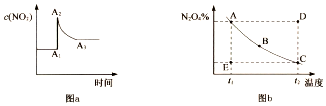
| A. | 其它条件不变时,向平衡体系中充入N2O4,平衡常数增大 | |
| B. | 图a中,A1一A2变化的原因一定是充人了NO2 | |
| C. | 图b中,E点对应状态中,v(正)>v(逆) | |
| D. | 图b中,E→A所需时间为x,D→C所需时间为y,则x<y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 3mol•L-1 NaClO3溶液 | B. | 100mL 2mol•L-1 FeCl3溶液 | ||
| C. | 150mL 3mol•L-1 KCl溶液 | D. | 150mL 1mol•L-1 MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉放入稀硫酸溶液:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 石灰石与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | Cl2通入水中:Cl2+H2O?H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
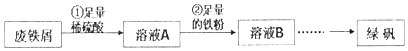
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com