
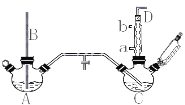
【题目】氯苯在染料、医药工业用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体,橡胶工业用于制造橡胶助剂。其合成工艺分为气相法和液相法两种,实验室模拟液相法(加热装置都已略去)如图,在C三颈烧瓶中加入催化剂FeCl3及50.0mL苯:
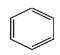 +Cl2
+Cl2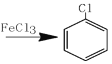 +HCl
+HCl
有关物质的性质:
名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
苯 | 78 | 78 | 0.88 |
氯苯 | 112.5 | 132.2 | 1.1 |
邻二氯苯 | 147 | 180.4 | 1.3 |
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中空导管B的作用是__。
(2)把干燥的氯气通入装有干燥苯的反应器C中制备氯苯,C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②__,球形冷凝管的作用是:__,D出口的主要尾气成分有__。
(3)提纯粗产品过程如图:

①净化过程中加入NaCl晶体的目的是吸水干燥,系列操作为__。
②为了确定所得产品为氯苯,而非二氯苯,可对产品进行分析,下列方法可行的是__。
A.质谱法 B.红外光谱法 C.滴定法
(4)实验中最终得到产品14.7g,产率为__,产率不高的原因可能是:___。
(5)苯气相氧氯化氢法制氯苯:空气、氯化氢气混合物温度210℃,进入氯化反应器,在迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,反应方程式为:__。
【答案】平衡气压 温度过高,苯挥发,原料利用率不高 冷凝回流,提高原料利用率 Cl2、苯蒸气、HCl 过滤、蒸馏 AB 23.2% 温度过高,反应生成二氯苯 2![]() +2HCl+O2
+2HCl+O2![]() 2
2 ![]() +2 H2O
+2 H2O
【解析】
本实验模拟液相法制取氯苯,装置A为制取氯气的装置,实验室一般利用二氧化锰和浓盐酸共热制取氯气,中空导管B可以防止装置内压强过高;装置C中进行氯气和苯的反应,球形冷凝管可以冷凝回流产品和苯,提高原料的利用率;之后进行产品的提纯,氯化液水洗、碱洗除去HCl、FeCl3等杂质,加入氯化钠晶体吸水干燥,过滤后的滤液蒸馏、精馏得到产品。
(1)中空导管B与大气相通,可以平衡装置内的压强;
(2)温度不宜过高,一是温度过高,反应得到二氯苯,二是温度过高会造成苯的挥发,降低原料的利用率;球形冷凝管可以冷凝回流挥发的苯,提高原料的利用率;D出口主要有未反应的氯气,反应生成的HCl以及挥发的苯蒸气;
(3)①加入氯化钠晶体吸收干燥后,经过滤得到粗品,此时杂质主要还有苯和二氯苯,再蒸馏、精馏得到产品;
②A.质谱法可以确定相对分子质量,氯苯、二氯苯相对分子质量不同,故A可行;
B.红外光谱可确定物质中所含官能团和化学键,氯苯和二氯苯结构不同,故B可行;
C.二者均为非电解质,无法电离出氯离子,无法利用滴定法区分,故C不可行;
故答案为AB;
(4)初始原料为50.0mL苯和过量的氯气,所以根据苯的量计算理论产量,苯的质量为0.88g/mL×50mL=44g,苯的物质的量为![]() mol,根据方程式可知理论生成氯苯
mol,根据方程式可知理论生成氯苯![]() mol,所以产率为
mol,所以产率为 =23.2%;产率不高的原因可能是:温度过高,反应生成二氯苯;
=23.2%;产率不高的原因可能是:温度过高,反应生成二氯苯;
(5)反应物有空气、氯化氢、苯,产物有氯苯,根据元素守恒可知产物应还有水,所以化学方程式为2![]() +2HCl+O2
+2HCl+O2![]() 2
2 ![]() +2 H2O。
+2 H2O。


科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
(2)从下表中选择,称量NaOH固体所需要的仪器是(填字母)________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
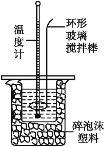
(1)若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:__________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算结果为____kJmol-1,与57.3 kJmol-1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置和方法进行相应实验,能达到实验目的是( )

A.装置A用于检验1-溴丙烷的消去产物
B.装置B用于石油的分馏
C.装置C用于实验室制硝基苯
D.装置D用于除去甲烷中混有的乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的描述正确的是![]()
A.铵明矾中加入过量的氢氧化钡溶液的离子方程式为![]()
B.![]() 中,当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol
中,当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol
C.强碱溶液中,用次氯酸钠与![]() 反应是湿法制备高铁酸钠的最主要过程,可表示为:
反应是湿法制备高铁酸钠的最主要过程,可表示为:![]()
D.将过量![]() 通入少量氨水中的离子方程式为:
通入少量氨水中的离子方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程不能达到实验目的的是( )
实验目的 | 实验过程 | |
A | 探究维生素C的还原性 | 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
B | 配制100mL1.0mol/L CuSO4溶液 | 将25.0gCuSO4·5H2O配成100mL溶液 |
C | 验证X溶液中是否含有Fe2+ | 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,观察溶液颜色变化 |
D | 除去固体KNO3中少量的NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤、洗涤、干燥 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如图:
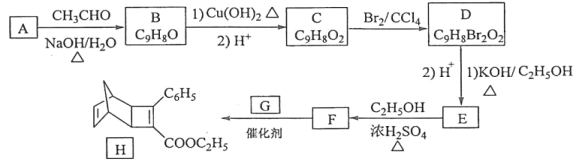
已知:
①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1)A的化学名称是___。
(2)由C生成D和E生成F的反应类型分别是__、__。
(3)E的结构简式为___。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为__。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式__、__。
(6)写出用环戊烷和2–丁炔为原料制备化合物 的合成路线__(其他试剂任选)。
的合成路线__(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制0.18 molL-1 醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取______g无水醋酸钠,溶于适量水中,配成500mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将______![]() 填“偏大”“偏小”或“无影响”
填“偏大”“偏小”或“无影响”![]() 。
。
方案二:用体积均为250mL且浓度均为______ molL-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖由约翰·B·古迪纳夫、M·斯坦利·威廷汉、吉野彰三人分获,以表彰他们研究锂离子电池做出的贡献。锂离子正极材料有LiMO2(M=Co、Ni、Mn) .
回答下列问题:
(1)基态Co原子价电子排布式为______,基态Li原子核外电子运动状态有____种。
(2)锂离子电池电解常用的锂盐有LiClO4、LiBF4等,常采用有机溶剂有乙醚、丙烯酯(![]() )等。
)等。
①LiClO4中阴离子空间构型为______,与其键合方式相同、空间构型也相同的离子和分子是___________________________ (各举一例).
②Li、Cl、F、B的电负性从大到小的顺序为_____;丙烯碳酸酯中碳原子的杂化方式是____。
③C2H5OC2H5(乙醚)的沸点比乙醇的低,其原因是________________。
(3)LiCoO2的晶胞是六棱柱,其结构如图所示:

晶胞中含氧原子数为_____,若晶胞的底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则LiCoO2的密度为_______g·cm —3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com