
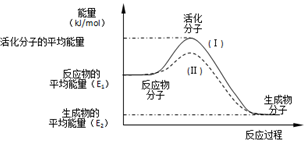
 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.分析 (1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;
(2)催化剂可降低反应的活化能;
(3)计算1mol甲苯燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(4)利用盖斯定律,将$\frac{②-①}{2}$可得△H1;
(5)盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)及其正逆反应的焓变数值相同符号相反.
解答 解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量,即△H=(E2-E1)kJ•mol-1,
故答案为:放热;E2-E1;
(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,
故答案为:使用了催化剂;
(3)0.01mol甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量,1mol甲苯(分子式为C7H8,常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出3943kJ的热量,则热化学方程式为:C7H8(l)+9O2(g)=7CO2(g)+4H2O(l)△H=-3943 kJ/mol,
故答案为:C7H8(l)+9O2(g)=7CO2(g)+4H2O(l)△H=-3943 kJ/mol;
(4)已知:①2H2(g)+O2(g)=2H2O(g);△H2=-483.6kJ•mol-1
②2C(s)+O2(g)=2CO(g);△H3=-221.0kJ•mol-1
为求C(s)+H2O(g)=CO(g)+H2(g);△H1的反应热,可用盖斯定律将$\frac{②-①}{2}$可得:
△H1=$\frac{483.6kJ/mol-221.0kJ/mol}{2}$=+131.3kJ/mol,
故答案为:+131.3;
(5)计算△H1时,将$\frac{②-①}{2}$可得△H1,其热效应总是相同的,为盖斯定律,故答案为:盖斯.
点评 本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,为高频考点,侧重于学生的分析能力的考查,读懂图象,焓变和活化能计算方法的理解以及明确热化学方程式的书写方法是解题关键,注意把握盖斯定律的含义,题目难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 建筑中使用的铝合金门窗比钢门窗更耐腐蚀 | |
| B. | 窗帘上直接受阳光照射的一面布料容易褪色 | |
| C. | 肉放在冷冻箱中要比放在保鲜箱中存放的时间更长久 | |
| D. | 实验室用硫酸溶液与锌粒反应制取氢气,反应一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又重新增多起来 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:
将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com