
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 10 |
| 3 |
| (0.03mol/L)2 |
| (0.03mol/L)2×0.16mol/L |
| 10 |
| 3 |
| 1mol×196.6KJ |
| 98.3KJ |
| 2mol |
| 4mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
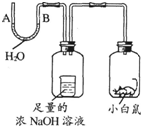
| A、A处上升,B处下降 |
| B、A、B两处都下降 |
| C、A处下降,B处上升 |
| D、A、B两处都不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| C、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
| D、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
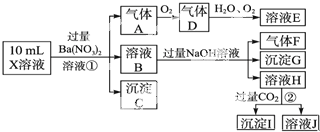
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com