
【题目】2019年是“国际化学元素周期表年”(IYPT2019)。我国华东师范大学80后科学家姜雪峰教授被遴选为硫元素的代言人。其课题组运用“从无机硫向有机硫”转化的理念,构建起了“3S绿色硫化学”。下列有关S的说法正确的是( )
A.位于元素周期表中第三周期第VA族
B.硫元素原子结构示意图: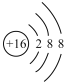
C.![]() S原子的中子数是32
S原子的中子数是32
D.有机化合物中可能含有硫元素
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L 氟化氢所含分子数为0.1NA
B.常温下,22.4 L 氯气与足量镁粉充分反应,转移的电子数为 2NA
C.丙烯和环丙烷组成的 42 g 混合气体分子中共用电子对总数为 9NA
D.化学反应中每生成 1 mol O2,转移的电子数为 4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
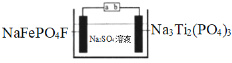
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项正确的是( )
A.NH4HCO3与足量氢氧化钠溶液反应的离子方程式:HCO3-+OH-=CO32-+H2O
B.铁与水蒸气反应的化学方程式:2Fe+3H2O(g)=Fe2O3+3H2
C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
D.钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+=2Na++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。
请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
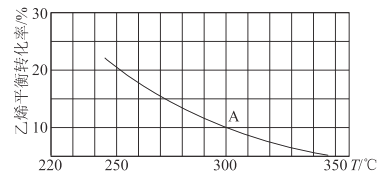
①该反应为____热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素
B.在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C.某基态原子的核外电子排布图为![]() ,它违背了泡利原理
,它违背了泡利原理
D.某价电子排布为3d14s2的基态原子,该元素位于周期表中第四周期第ⅢB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用Na2O2设计装置验证某些物质的性质。甲组:在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
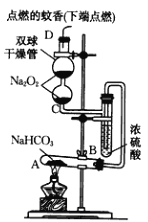
(1)在A试管内发生反应的化学方程式是__。
(2)B装置的作用是__。
(3)在双球干燥管内发生反应的化学方程式__,当有1molNa2O2发生反应,转移电子数目为__;双球干燥管内观察到的实验现象是__。
(4)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
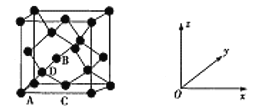
【题目】锗是典型的半导体元素,在电子、材料等领域应用广泛。
(1)写出Ge原子结构示意图___。
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是___。
(3)Ge单晶具有金刚石型的结构,如图为晶胞结构,其中原子坐标参数A为(0,0,0),B为(![]() ,0,
,0,![]() ),C为(
),C为(![]() ,
,![]() ,0),D原子的坐标参数为___;若晶胞参数为anm,NA表示阿伏伽德罗常数,则其晶胞密度为___g/cm3(列出计算式即可)。
,0),D原子的坐标参数为___;若晶胞参数为anm,NA表示阿伏伽德罗常数,则其晶胞密度为___g/cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com