
分析 (1)NaHCO3完全反应,反应生成碳酸钙、水、NaOH;
(2)至Al3+恰好完全沉淀,生成硫酸钡、氢氧化铝;
(3)H2O2和酸性KMnO4发生氧化还原反应生成锰离子、氧气;
(4)由优先氧化可知,氯气不足,亚铁离子全被氧化,而溴离子部分被氧化.
解答 解:(1)NaHCO3完全反应,反应生成碳酸钙、水、NaOH,离子反应为HCO3-+Ca2++OH-=CaCO3↓+H2O,故答案为:HCO3-+Ca2++OH-=CaCO3↓+H2O;
(2)至Al3+恰好完全沉淀,生成硫酸钡、氢氧化铝,离子反应为2Al3++3SO42-+3Ba2++6OH-═2 Al(OH)3↓+3BaSO4↓,
故答案为:2Al3++3SO42-+3Ba2++6OH-═2 Al(OH)3↓+3BaSO4↓;
(3)H2O2和酸性KMnO4发生氧化还原反应生成锰离子、氧气,离子反应为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
(4)由优先氧化可知,氯气不足,亚铁离子全被氧化,而溴离子部分被氧化,离子反应为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-,故答案为:4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
点评 本题考查离子反应方程式的书写,为高频考点,把握习发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g | |
| B. | 摩尔是表示物质微粒数目的一个物理量 | |
| C. | 3.01×1023个SO2分子的质量为64g | |
| D. | 标准状况下,1 mol任何物质体积均约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.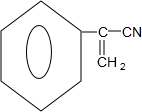 ,E中含氧官能团的名称为羧基.
,E中含氧官能团的名称为羧基. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为
;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为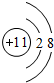
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .写出C与NaOH水溶液共热反应的化学方程式
.写出C与NaOH水溶液共热反应的化学方程式 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaBr+H2O.
+2NaBr+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com