
| A、医疗上常用酒精作消毒剂 |
| B、用福尔马林对种子消毒 |
| C、鸡蛋白溶液中加入食盐变浑浊 |
| D、用氯化汞消毒医疗器械 |


科目:高中化学 来源: 题型:
| ||
| A、22.4 L |
| B、44.8 L |
| C、67.2 L |
| D、89.6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
| c(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第8min时 A的反应速率为0.08mol?L-1?min-1 |
| B、在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C、30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D、反应方程式中的x=1,且正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
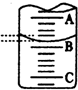 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.22 | 25.35 | 25.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com