
| A. |
| |||||||||
| B. |
| |||||||||
| C. | 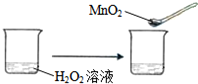 | |||||||||
| D. | 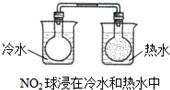 |
分析 平衡移动原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A、氯水的浓度缩小一倍,PH减小不到一个单位,说明加水稀释过程,促进氯气和水的反应的平衡的移动,所以符合勒夏特列原理,故A不选;
B、水的电离是吸热过程,升高温度促进电离,所以水的离子积常数变大,所以符合勒夏特列原理,故B不选;
C、使用催化剂平衡不移动,所以不符合勒夏特列原理,故C选;
D、二氧化氮转化为四氧化二氮是放热反应,所以放在热水中,平衡向生成二氧化氮方向移动,所以颜色加深,符合勒夏特列原理,故D不选;
故选C.
点评 本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理内涵及适用范围是解本题关键,注意:平衡移动原理只适用于“改变条件时能引起平衡移动的化学反应”,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 24g镁的原子最外层电子数为NA | |
| B. | 0.3mol O2与一定量的Fe3+在一定条件下完全反应,生成Fe2O3和Fe3O4的混合物,则转移电子数为1.2mol | |
| C. | 2L 0.1mol/L氯化铁溶液中含有Fe的数目为0.2NA | |
| D. | 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向FeCl2溶液中通入Cl2,然后滴加KSCN溶液 | 验证Cl2的氧化性比Fe3+强 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中不一定含有SO42- |
| C | 用洁净的玻璃棒蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,一定无K+ |
| D | 将某气体通入品红溶液中,溶液褪色 | 该气体中一定含有SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁和稀硫酸:Mg+2H+═Mg2++H2↑ | |
| B. | 硅和烧碱溶液:Si+2OH-+H2O═SiO32-+2H2↑ | |
| C. | NaHCO3溶液和足量Ca(OH)2溶液Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 氯化铝溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2 OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | a处溶液的pH增大,b处溶液的pH减小 | |
| C. | 一段时间后,a管液面高于b管液面 | |
| D. | 两侧生铁丝发生相同的电极反应:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH均等于4的硫酸溶液与醋酸溶液,两种溶液中c(SO42-)与c(CH3COO-)之比为1:2 | |
| B. | 常温下,向pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)和c(OH-)都将变小 | |
| C. | 常温下,0.1mol/L NaHA溶液的PH=5,溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com