

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
分析 (1)装置A中发生的反应是MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,反应式中HCl和MnCl2可拆分,其余仍用化学式表示,最终可得离子方程式;
(2)PCl3遇水会强烈水解生成H3PO3和HCl,D中反应需要在无水条件下进行,而A中制得的氯气中混有水汽和HCl,通过B装置时要干燥氯气,故装置B盛放浓硫酸,E装置支管圆底烧瓶是收集生成的PCl3,考虑到PCl3的熔沸点较低,很容易挥发,结合到冷水是降温的,可知E中冷水的作用应该是冷凝PCl3,碱石灰有吸水和吸酸性气体的作用,本实验的尾气氯气有毒,对环境有污染,可被碱石灰吸收,同时还可以防止空气中的水汽进入烧瓶内与PCl3反应;
(3)白磷遇氧易因缓慢氧化而引起自发燃烧,装置中的空气含有氧气,通入干燥的CO2可达到目的;
(4)加入黄磷加热除去PCl5后,粗产品中含有的POCl3和PCl3熔沸点存在明显的差异,结合混合物常见的分离方式,可选择蒸馏操作.
解答 解:(1)装置A中发生的反应是MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,经改写可得:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)防止生成的PCl3水解,参加反应的氯气必须要干燥,可利用B装置中盛装的浓硫酸干燥氯气;实验中多余的氯气有毒,如果直接排放会污染空气,另外如果空气的水进入烧瓶,会导致PC13水解,结合碱石灰的性质可知是吸收尾气氯气,同时防止空气中的水汽进入烧瓶,
故答案为:浓H2SO4;吸收多余的氯气,防止空气中的水汽进入烧瓶与PC13反应;
(3)白磷遇氧气会自燃,故要排除装置中的空气,可通过通入的CO2达到目的,
故答案为:排尽装置中的空气,防止白磷自燃;
(4)POCl3和PCl3熔沸点存在明显的差异,除去PC13中混有的POCl3,可选择蒸馏的方式进行分离,以得到纯净的PCl3,
故答案为:蒸馏.
点评 考查制备实验的基本操作及注意事项,提醒学生时刻关注生成物的特殊的性质,混合物的分离提纯和滴定实验的数据处理,考查学生综合处理问题的能力,中等难度.


科目:高中化学 来源: 题型:选择题
| A. | ①和②混合溶液中:c(H+)=3.0mol•L-1 | |
| B. | ①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | ②和③混合溶液中:c(Cl-)>c(NH4+) | |
| D. | 四种溶液稀释100倍,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | R | W |
| 原子半径/pm | 160 | 143 | 89 | 70 | 66 |
| 主要化合价 | +2 | +3 | +2 | +5、-3 | -2 |
| A. | X、Z元素的金属性:X<Z | |
| B. | 一定条件下,R单质与常见的W单质能直接生成RW2 | |
| C. | 气态氢化物的稳定性:R>W | |
| D. | Y的最高价氧化物既能溶于H2SO4又能溶于NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +
+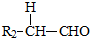 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$ (R,R’为烃基或氢)
(R,R’为烃基或氢)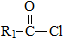 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$ +HCl (R,R’为烃基)
+HCl (R,R’为烃基) .
.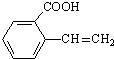 、
、 、
、 、
、 (其中之一).
(其中之一). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,28g N2中含有氮原子的个数为2NA | |
| B. | 在标准状况下,22.4L H2O中含有氢原子的个数为2NA | |
| C. | 1mol Fe 与盐酸反应完全反应失去的电子数为3NA | |
| D. | 1mol/L NaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C和Si元素在化学中占有极其重要的地位.
C和Si元素在化学中占有极其重要的地位. ;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.
;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com