
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
B | 向2mL0.1mol/LNa2S溶液中滴2滴0.1mol/LZnSO4溶液;再滴2滴0.1mol/LCuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶解度(Ksp):ZnS>CuS |
C | 在稀硫酸中加入铜,再加入硝酸钠固体 | 开始无现象,后铜逐步溶解,溶液变蓝,有气泡产生 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
A. A B. B C. C D. D
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次月考化学试卷(解析版) 题型:选择题
0.1mol某有机物的蒸气跟过量O2混合后点燃,生成13. 2 g CO2和5.4gH2O,该有机物跟金属钠反应放出H2,又能跟新制Cu(OH)2悬浊液共热生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物,该酯类化合物的结构简式可能是
A. CH3-CH(OCH3)-CHO B. 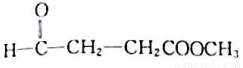
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
八硝基立方烷的结构如图所示(碳原子未画出),是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是
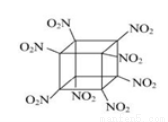
A. 该物质爆炸产物是N2、CO2、H2O
B. 1 mol该分子中含8 mol二氧化氮
C. 该物质可由立方烷发生取代反应制得
D. C、N间形成非极性键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
下列说法正确是的
A. 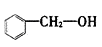 属于酚类,官能团为-OH
属于酚类,官能团为-OH
B. 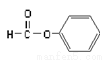 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. 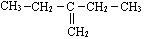 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. H2C=CH-CH=CH2的名称为:1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:选择题
锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用。
(1)已知相关热化学方程式为:
4Al(s)+3O2(g)=2Al2O2(s) △H1=a kJ•mol﹣1
3MnO2(s)=Mn3O4(s)+O2(g) △H2=bkJ•mol﹣1
3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) △H3=ckJ•mol﹣1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) △H=__ kJ•mol﹣1(用含a、b、c的代数式表示).
(2)MnCO3广泛用作锰盐原料.通过如图装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)。
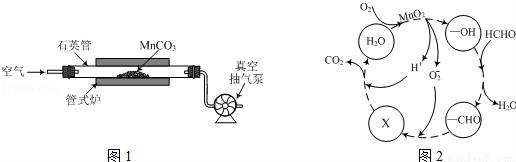
①2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g)的化学平衡常数表达式K=______。
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还有______。
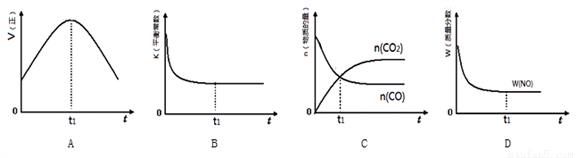
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中V正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(3)MnO2常用作催化剂。MnO2催化降解甲醛的反应机理如图所示,图中X表示的粒子是______,该反应的总反应方程式为______。
(4)MnSO4是重要微量元素肥料。用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:______,电解过程中阴极附近的pH______(选填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:填空题
X、Y、Z、W四种元素原子序数依次增大且均小于36。Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子。 回答下列问题(以下问题均以推知元素符号作答):
(1)若YX3与X2Z、YX2-与ZX-、Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式_________________。
(2)已知X2Z晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因与下列因素有关的是______。
①氢键的方向性 ②氢键的饱和性 ③水中氧的杂化方式与金刚石中碳的杂化方式一样 ④晶体类型相似
(3) WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为_________,其核外电子有________种运动状态。
②尿素分子中碳原子的杂化方式为_________,1mol尿素分子中含有的σ键数为______NA。
③YZ3-的空间构型________,与之互为等电子体的阴离子如________,中性分子如________;HYZ3与HYZ2 中酸性偏强的是(写化学式)__________。
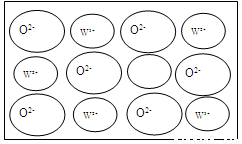
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如下图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6:91。若该晶体的化学式为WxZ,则x=_____。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
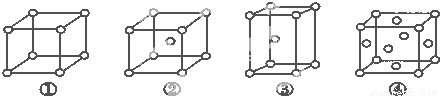
A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12
D.空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:实验题
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠

已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:实验题
某同学设计了如下装置用于制取SO2并验证SO2的部分性质。回答下列问题:
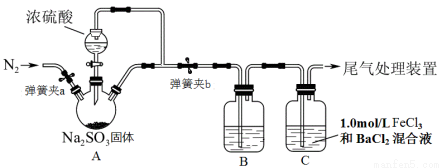
(1)装置A中用于添加浓硫酸的仪器名称为 。
(2)某同学为了检验装置中A、B两部分的气密性,进行的操作是:关闭弹簧夹a、打开弹簧夹b,用酒精灯在三口烧瓶下微热,观察到C中长导管口有明显气泡现象,他判断气密性良好。你认为是否合理________。(填“合理”或“不合理”)
(3)实验前要在装置中鼓入N2,目的是 。
(4)为了验证SO2是酸性氧化物,B中可选用的试剂是( )
A.无色酚酞溶液 B.蓝色石蕊试液
C.红色品红溶液 D.KI淀粉混合溶液
(5)装置C中可观察到白色沉淀现象,由此可验证SO2具有 性,相关反应的离子方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com