
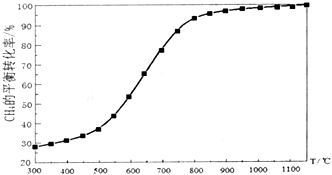
 合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.
合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.| 碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$] | 1:0.25 | 1:0.5 | 1:1 | 1:1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
分析 (1)已知①C(s)+H20(g)?C0(g)+H2(g)△H1
②C(s)+$\frac{1}{2}$O2(g)=C0(g)△H2=-110.5kJ•mol-1
③H2(g)+$\frac{1}{2}$02(g)=H20(g)△H3=-242kJ•mol-1
根据盖斯定律①=②-③,△H1=△H2-△H3,再根据反应自发进行的判断依据△G=△H-T△S判断;
(2)根据化学平衡时,正逆反应速率相等,各组分含量保持不变进行分析;
(3)根据高温时,有利于吸热反应;
(4)该反应是个体积增大的反应,压强增大,反应逆向移动,甲烷的转化率较小;
(5)根据图表数据,CH4的转化率及H2、CO的选择性,均较大为最佳碳氧比;再由选择性=$\frac{目标产物的产率}{反应原料的转化率}$和目标产物的产率=$\frac{目标产物实际量}{目标产物的理论产量}$计算.
解答 解:(1)已知①C(s)+H20(g)?C0(g)+H2(g)△H1
②C(s)+$\frac{1}{2}$O2(g)=C0(g)△H2=-110.5kJ•mol-1
③H2(g)+$\frac{1}{2}$02(g)=H20(g)△H3=-242kJ•mol-1
根据盖斯定律①=②-③,△H1=△H2-△H3=131.5kJ>0,反应①气体体积减小,则△S>0,当温度较高时,△G=△H-T△S<0,能自发进行;
故答案为:高温;△H1=△H2-△H3=131.5kJ>0,△S>0;
(2)反应C(s)+H20(g)?C0(g)+H2(g))
A.恒温恒容,则体积不变,而混合气体的质量增大,即随着反应的进行ρ=$\frac{m}{V}$增大,混合气体的密度不再改变时说明反应到达平衡状态,故A正确;
B.各组分的物质的量相等不能说明反应平衡,故B错误;
C.反应体系中,当有2molH-0键断裂说明有1molH-H键生成,同时有1molH-H键断裂,说明正逆反应速率相等,反应平衡,故C正确;
D.随着反应的进行混合气体的总质量和总物质的量均变化,混合气体的平均相对分子质量为18且保持不变时,反应达到平衡,故D正确;
故答案为;ACD;
(3)高温时,有利于吸热反应,故Ⅱ占主导作用,故答案为:Ⅱ;
(4)该反应是个体积增大的反应,压强增大,反应逆向移动,甲烷的转化率较小所以图象为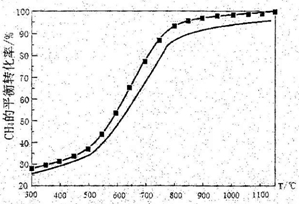 ;
;
故答案为: ;
;
(5)CH4的转化率及H2、CO的选择性,均较大时为最佳碳氧比,根据图表数据,最佳碳氧比为1:0.5;
反应2CH4(g)+02(g)?2CO(g)+4H2(g),通入CH4和02各amol时,CO理论生成amol,则CO的产率为:$\frac{n(CO)}{a}$,由图表数据,[$\frac{n(C{H}_{4})}{n({O}_{2})}$]=l:1时,CH4的转化率为0.98,CO的选择性为0.65,则有:0.65=$\frac{\frac{n(CO)}{a}}{0.98}$
则n(CO)=a×0.98×0.65mol,则c(CO)=$\frac{a×0.98×0.65}{V}$mol/L;
故答案为:1:0.5;$\frac{a×0.98×0.65}{V}$mol/L.
点评 本题考查了反应自发进行的条件,化学平衡的判断以及有关化学平衡的计算,题目较灵活,难度较大,(5)题读懂题目给出的信息是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯(
苯乙烯(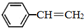 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△=-Q1kJ.mol-1
=CH2(g)+H2(g)△=-Q1kJ.mol-1 .
.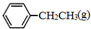 、
、 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl溶解度大于Ag2CrO4溶解度 | |
| D. | 25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| B. | 常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>② | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性 | |
| D. | 物质的浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:③>①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com