
分析 (1)AlCl3为强酸弱碱盐,铝离子水解导致溶液呈酸性;将AlCl3溶液蒸干过程中,氯化铝水解生成HCl和Al(OH)3,温度越高HCl挥发性越强,导致蒸干时得到的固体是Al(OH)3,灼烧Al(OH)3得到的固体是氧化铝;
(2)Sn2+水解呈酸性,加盐酸可抑制Sn2+离子的水解;
(3)纯碱溶液去油污的原理,碳酸根离子的水解显碱性,油脂在碱溶液中发生水解生成溶于水的高级脂肪酸盐和甘油容易洗去.
解答 解:(1)AlCl3为强酸弱碱盐,铝离子水解导致溶液呈酸性,水解方程式为Al3++3H2O?Al(OH)3+3H+;将AlCl3溶液蒸干过程中,氯化铝水解生成HCl和Al(OH)3,温度越高HCl挥发性越强,导致蒸干时得到的固体是Al(OH)3,灼烧Al(OH)3得到的固体是氧化铝,方程式为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;Al2O3;
(2)Sn2+水解呈酸性,在配制SnCl2溶液时,为了防止Sn2+发生水解,可以加入少量的盐酸,
故答案为:HCl;
(3)纯碱溶液去油污的原理,碳酸根离子的水解显碱性,反应的离子方程式为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,油脂在碱溶液中发生水解生成溶于水的高级脂肪酸盐和甘油容易洗去,
故答案为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
点评 本题考查盐类水解原理及应用,为高频考点,题目难度不大,明确盐的水解原理为解答关键,试题注意盐的水解原理在配制溶液中的应用方法,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,A的结构简式
,A的结构简式 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定大于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定小于92.0 kJ | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{115{w}_{2}-84{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84({w}_{1}-{w}_{2})}{31{w}_{1}}$ | ||
| C. | $\frac{73{w}_{2}-42{w}_{1}}{31{w}_{1}}$ | D. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
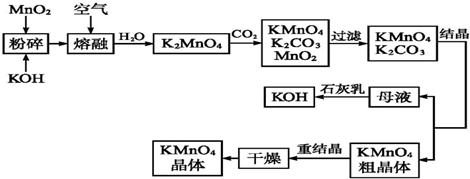
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com