
| A. | 25℃时,pH=4.5的硫酸溶液中c(H+) 是pH=5.5的磷酸中c(H+)的10倍 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金的耐腐蚀性都较差 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 常温下,2NO(g)+O2(g)?2NO2(g)能够自发进行,则该反应的△H<0 |
分析 A.根据pH=-lgc(H+)计算;
B.不锈钢等耐腐蚀;
C.催化剂不能使平衡移动;
D.根据反应自发进行的判断依据:△H-△S<0解答.
解答 解:A.pH=4.5的硫酸溶液中c(H+)为10-4.5mol/L,pH=5.5的磷酸中c(H+)为10-5.5mol/L,前者是后者的10倍,故A正确;
B.不是所有的合金耐腐蚀都很差,例如钛合金、铝合金等具有很好的抗腐蚀性能,故B错误;
C.催化剂不能使平衡移动,只改变反应速率,故C错误;
D.由方程式2NO(g)+O2(g)?2NO2(g)可知该反应△S<0,要使△H-△S<0,必须满足△H<0,故D正确.
故选AD.
点评 本题考查较为综合,涉及金属的腐蚀与防护,pH的计算以及反应方向判据,为高考常见题型,考查学生对基本知识的掌握程度,难度不大.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H10 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化一定会产生新的核素 | |
| B. | 明矾净水过程涉及化学变化 | |
| C. | 催化剂能改变化学反应的活化能和焓变 | |
| D. | 在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径: 途径a:Fe$\stackrel{H_{2}SO_{4}}{→}$H2$→_{△}^{Cu}$Cu 途径b:CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu 实际操作中,制得等质量的铜时,途径a和途径b消耗Fe的质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
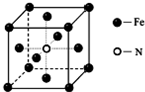 NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.
NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: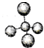 | B. | NH4Br的电子式: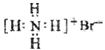 | ||
| C. | 氯原子的结构示意图: | D. | 邻羟基苯甲酸的结构简式: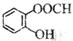 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
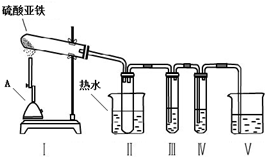
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com