
室温下,将0.1mol/L的H2 SO4溶液分别缓慢注入以下四种浓度均为0.1mol/L的溶液,各指标随加人H2 SO4溶液体积变化曲线图错误的是
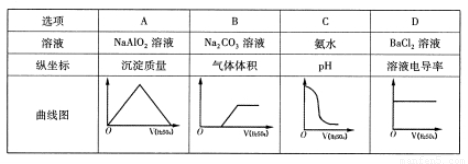
A、D
【解析】
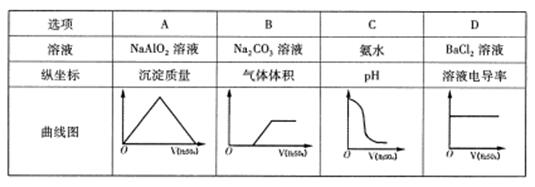
试题分析:A. 向NaAlO2溶液中加入H2SO4,首先发生反应:2NaAlO2+ H2SO4+2H2O= Na2SO4+2Al(OH)3↓.当H2SO4过量时又发生:3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O .前后消耗的硫酸的体积比为1:3.错误。B.向Na2CO3溶液中加入硫酸时首先发生反应:2Na2CO3+ H2SO4= Na2SO4+ 2NaHCO3;然后发生反应2NaHCO3+ H2SO4= Na2SO4+ H2O+ CO2↑。当溶液中所有生成的NaHCO3完全反应转化为Na2SO4时气体体积达到最大值,再加入硫酸也不产生气体。正确。C.氨水呈碱性,溶液的pH>7,当向溶液中加入H2SO4时发生酸碱中和反应:2NH3·H2O+ H2SO4= (NH4)2SO4+2H2O.当二者恰好发生中和反应时溶液的pH会有一个大的突变,然后就是H2SO4和(NH4)2SO4的混合溶液,显酸性,pH<7正确。D. 对于BaCl2溶液来说电离产生大量的Ba2+和Cl-,所有溶液能导电,当向溶液中加入H2SO4时,发生反应:BaCl2+ H2SO4=BaSO4↓+2HCl。溶液中导电的微粒为H+和Cl-.一个Ba2+的导电性与2个H+的导电能力相同,但由于溶液的体积增大,所以自由移动的离子的浓度减小,溶液的导电能力减弱。错误。
考点:考查物质的量的多少对化学反应的影响的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 溶液 | NaAlO2溶液 | Na2CO3溶液 | 氨水 | BaCl2溶液 |
| 纵坐标 | 沉淀质量 | 气体体积 | PH | 溶液电导率 |
| 曲线图 | 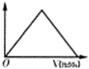 |
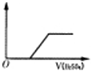 |
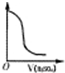 |
 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,将0.1mol/L的一元酸HA的溶液与0.1mol/L的一元碱BOH的溶液等体积混合,所得溶液显中性 | B、将10mLPH=12的NaOH溶液PH变为11,可加入100mL的水 | C、25℃时,PH=10的NaOH溶液和PH=4的盐酸溶液中水的电离程度相等 | D、使用PH试纸测溶液PH时,若使用前润湿PH试纸,会使所测PH偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足
量的锌粒反应,产生的气体体积前者__________后者(填“<”“>”或“=”)。
(2)在25 ℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字
母,下同)__________。
A.5 B.7 C.3~5之间 D.5~7之间
(3)25 ℃时,向0.1 mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶
液pH将__________。
A.增大 B.减小 C.不变 D.无法确定
(4)室温下,向0.1mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又
不影响H2的体积,可以向硫酸溶液中加入__________试剂。
A.碳酸钠晶体 B.醋酸钠晶体 C.滴加少量硫酸铜溶液 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将0.1mol·L—H2 S04溶液分别缓慢注入以下四种浓度均为0.1mol·L一的溶液,各指标随加人H2 S04溶液体积变化曲线图错误的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com