
| A. | 0.01mol | B. | 0.005mol | C. | 0.0133mol | D. | 0.0mol |
分析 0.1mol/L明矾溶液 100mL中KAl(SO4)2•12H2O为0.01mol,则溶液中含有0.01molK+、0.01molAl3+、0.02molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要0.02molBa2+,即0.02molBa(OH)2,0.02molBa(OH)2中含有0.04molOH-,0.01molAl3+和0.04molOH-发生反应:Al3++4OH-═AlO2-+2H2O,据此进行解答.
解答 解:0.1mol/L明矾溶液 100mL中KAl(SO4)2•12H2O为0.01mol,则溶液中含有0.01molK+、0.01molAl3+、0.02molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要0.02molBa2+,即0.02molBa(OH)2,0.02molBa(OH)2中含有0.04molOH-,0.01molAl3+和0.04molOH-发生反应:Al3++4OH-═AlO2-+2H2O,所以铝元素全部转化为偏铝酸盐,故选D.
点评 本题考查离子方程式的计算,题目难度中等,正确判断SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量为解答关键,注意明确铝离子与氢氧根离子反应特点,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
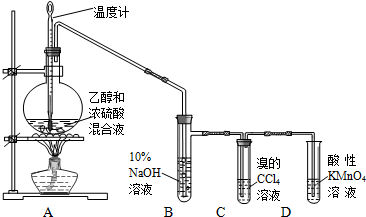 实验室制取乙烯并检验乙烯性质的装置如图.
实验室制取乙烯并检验乙烯性质的装置如图. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①②③ | C. | 只有①②③④ | D. | 都可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下镁铝表面能生成一层致密的氧化膜,保护内层的金属不被继续氧化 | |
| B. | 未打磨的铝箔因表面有氧化膜,因此在空气中加热后不能燃烧,若将氧化膜去除后再加热,则可在空气中燃烧 | |
| C. | 在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强 | |
| D. | 因铜是不活泼金属,故即使在潮湿的空气中也不会被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图  | B. | 铁红的化学式为Fe3O4 | ||
| C. | 甲醛的结构简式:CH2O | D. | CO2的电子式  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅不能作为新能源开发的材料 | B. | 硅不可能与同主族的碳形成化合物 | ||
| C. | 二氧化硅属于离子化合物 | D. | 获取新能源不一定要发生化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com