
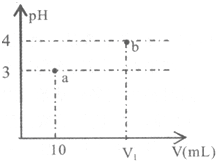
| A. | 若V1=100,则稀释前A的浓度一定是0.001mol/L | |
| B. | 若A为NH4Cl和HCl的混合溶液,则V1一定大于100 | |
| C. | a点水的电离程度一定小于b点 | |
| D. | 若A为NH4Cl和NH3•H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
分析 A.10mLpH=3的A溶液中加水稀释到V1mL溶液,PH=4,若V1=100,则是稀释10倍溶液PH增大一个单位,证明是强酸;
B.若A为NH4Cl和HCl的混合溶液,溶液中铵根离子水解溶液显酸性,加水稀释促进水解平衡正向进行;
C.向10mLpH=3的A溶液可能是酸溶液,也可能是水解的盐溶液;
D.若A为NH4Cl和NH3•H2O的混合溶液,依据溶液中电荷守恒分析判断;
解答 解:A.10mLpH=3的A溶液中加水稀释到V1mL溶液,PH=4,若V1=100,则是稀释10倍溶液PH增大一个单位,证明是强酸,但可以是一元酸也可以是二元酸,所以远酸溶液浓度不一定为0.001mol/L,故A错误;
B.若A为NH4Cl和HCl的混合溶液,溶液中铵根离子水解溶液显酸性,加水稀释促进水解平衡正向进行,加水稀释到100ml,不考虑水解平衡移动,溶液PH变化为4,单铵根离子水解,溶液PH小于4,所以V1一定大于100,故B正确;
C.向10mLpH=3的A溶液可能是酸溶液,也可能是水解的盐溶液,若为酸溶液a点水的电离程度一定小于b点,若为水解的盐溶液加入水稀释促进水解正向进行,水的电离程度减小,a点水的电离程度大于b点,故C错误;
D.若A为NH4Cl和NH3•H2O的混合溶液,溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),溶液显酸性,则(H+)>c(OH-),c(NH4+)<c(Cl-),故D错误;
故选B.
点评 本题考查了弱电解质电离平衡、电离平衡影响因素、弱电解质溶液中稀释溶液PH变化、溶液中电荷守恒的判断,掌握基础是解题关键,题目难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | OH-、K+、CO32-、Cl2 | B. | Na+、OH-、NH4+、Cl- | ||
| C. | Fe3+、Na+、NH3.H2O、NO3- | D. | K+、Al3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子是高度对称的平面形分子 | |
| B. | 苯与溴水混合无明显现象 | |
| C. | 苯不与酸性KMnO4溶液反应 | |
| D. | 1 mol C6H6在一条件下可与3 mol Cl2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
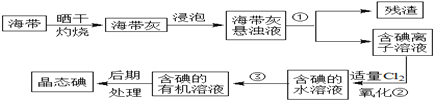
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
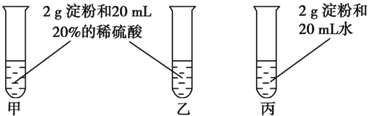
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
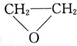
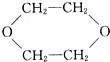
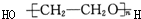
| A. | 只有① | B. | ②③ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③② | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 质子数相同的微粒,它们的化学性质基本相同 | |
| C. | 苯和溴苯的混合物可用分液法分离 | |
| D. | 由“C(石墨)→C(金刚石)△H=+1.9 kJ/mol”可知石墨比金刚石稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com