
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减
少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
A.22.1 g B.27.2 g C.30 g D.无法计算
科目:高中化学 来源: 题型:
金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是
( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Cu都是用热还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L恒容密闭容器中充入2 mol X和lmol Y发生反应: , 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
A.4KI+O2+2H2O=4KOH+2I2
B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2 Ca
C.I2+2NaClO3=2NaIO3+Cl2
D.MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法中正确的是
A.溶液中Ca2+数目减少 B.溶液中c(Ca2+)增大
C.溶液的pH增大 D.溶液中溶质的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的Fe 、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体(唯一还原产物)的体积与所得到剩余固体质量记录如下表(所有的气体的体积均在标准状况下测定)
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| HNO3溶液的体积(mL) | 100 | 200 | 300 | 400 | 500 |
| 剩余固体的质量(g) | 17.2 | 8 | 0 | 0 | 0 |
| 气体的体积(L) | 2.24 | 4.48 | 6.72 | 7.84 | 7.84 |
(1)该实验中所用的硝酸的物质的量浓度为 mol/L
(2)第1次实验反应的离子方程式 ,第2次实验后剩余固体的成份为
(填化学式)
(3)求实验中每次所取混合物中铜的质量 g
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体.D的俗名叫铁红,A是形成酸雨的主要气体。则:
(1)在周期表中,组成单质I的元素位于第 周期 族;
(2)写出S2-的离子结构示意图: ;写出N2的结构式: ;
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应是 ;(填写序号)
(4)反应④的离子方程式是: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) == 2NO2(g) ΔH= + 67.7kJ·mol-1
N2H4(g) + O2(g)== N2(g) + 2H2O(g) ΔH= - 534.0kJ·mol-1
2NO2(g)  N2O4(g) ΔH= - 52.7kJ·mol-1
N2O4(g) ΔH= - 52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
 ①已知该反应的平衡常数K与温度的关系如图,则此反应的Q <
①已知该反应的平衡常数K与温度的关系如图,则此反应的Q <
0
(填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为
0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, ABC
(选填编号).
A.容器中气体的平均相对分子质量不随时间而变化 B. v(N2)/v(O2)=2∶3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
E.若向容器中继续加入N2,N2的转化率将增大
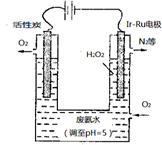 (4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约
为5,则所得废氨水溶液中c(NH4+) c(NO3-)(填“>”“<”或
“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量
为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com