
| A£® | ·“Ó¦¢Ł”¢¢Ś¾łĪŖŃõ»Æ»¹Ō·“Ó¦ | |
| B£® | ·“Ó¦¢ŁÖŠŃõ»Æ²śĪļÓė»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ1 | |
| C£® | ÉĻŹöĪ²ĘųN0xµÄĪüŹÕ¹ż³ĢÖŠ£®¹²×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ1mol | |
| D£® | ÉĻŹöĪ²ĘųÖŠNO2ÓėN0µÄĢå»ż±ČĪŖ6£ŗ1£® |
·ÖĪö A”¢Ńõ»Æ»¹Ō·“Ó¦ŹĒ“ęŌŚŌŖĖŲ»ÆŗĻ¼Ū±ä»ÆµÄ·“Ó¦£»
B”¢·“Ó¦¢ŁÖŠNaNO3ŹĒŃõ»Æ²śĪļ£¬NaNO2ŹĒ»¹Ō²śĪļ£»
C”¢øł¾Ż»ÆŗĻ¼ŪÉż½µĒéæöČ·¶Øµē×Ó×ŖŅʵďżÄ棻
D”¢øł¾Ż¶žŃõ»ÆĢ¼ĘųĢåĢå»żŗĶČÜŅŗÖŹĮæŌö¼ÓµÄĮæĮŠ·½³Ģ×é½ā³öŅ»Ńõ»ÆµŖŗĶ¶žŃõ»ÆµŖµÄĢå»ż£¬“Ó¶ųµĆ³öĘäĢå»żÖ®±Č£®
½ā“š ½ā£ŗA”¢·“Ó¦¢Ł”¢¢Ś¾ł“ęŌŚŌŖĖŲ»ÆŗĻ¼Ū±ä»Æ£¬ĪŖŃõ»Æ»¹Ō·“Ó¦£¬¹ŹAÕżČ·£»
B”¢·“Ó¦¢ŁÖŠNaNO3ŹĒŃõ»Æ²śĪļ£¬NaNO2ŹĒ»¹Ō²śĪļ£¬¢ŁÖŠŃõ»Æ²śĪļÓė»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ1£¬¹ŹBÕżČ·£»
C”¢ÉĻŹöĪ²ĘųN0xµÄĪüŹÕ¹ż³ĢÖŠ£¬»ÆŗĻ¼ŪÉż½µĒéæöČ·¶ØÖµ=µē×Ó×ŖŅʵďżÄæ¹²×ŖŅʵē×ÓµÄĪļÖŹµÄĮæ»ÆŗĻ¼ŪÉż½µĒéæöČ·¶Øµē×Ó×ŖŅʵďżÄæ=1mol£¬¹²×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ1mol£¬¹ŹCÕżČ·£»
D”¢2NO2+Na2CO3=NaNO2+NaNO3+CO2£¬”÷m=48g£»NO+NO2+Na2CO3=2NaNO3+CO2£¬”÷m=32g£»½įŗĻ·“Ó¦·½³ĢŹ½£¬ÖŖĪüŹÕNOxµÄĪļÖŹµÄĮæĪŖ2mol£¬ŠĪ³ÉµÄÄĘŃĪÖŠNa”«N£¬Ķ¬Ź±²śÉś1 mol CO2£¬0.5L 2mol/LµÄ“æ¼īµÄĪļÖŹµÄĮæŹĒ1mol£¬ÉčNOµÄĪļÖŹµÄĮæŹĒx£¬NO2µÄĪļÖŹµÄĮæŹĒy£¬Ōņx+$\frac{y-x}{2}$=1mol£¬32x+24£Øy-x£©=44£¬½āµĆ£ŗx=0.25mol£¬Y=1.75mol£¬¼“Ņ»Ńõ»ÆµŖŗĶ¶žŃõ»ÆµŖµÄĪļÖŹµÄĮæÖ®±Č=1£ŗ7£¬ĖłŅŌĻąĶ¬Ģõ¼žĻĀ£¬¶žŃõ»ÆµŖŗĶŅ»Ńõ»ÆµŖµÄĢå»żÖ®±ČŹĒ7£ŗ1£¬¹ŹD“ķĪó£®
¹ŹŃ”D£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éĮĖµŖŃõ»ÆĪļ”¢Ńõ»Æ»¹ŌÖŠµÄ»ł±¾øÅÄī£¬²éѧæ¼Éś¶Ō»ł“”ÖŖŹ¶µÄÓ¦ÓĆÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦£¬ÕĘĪÕµŖµÄŃõ»ÆĪļµÄ»ÆѧŠŌÖŹŹĒ½ā“šµÄ¹Ų¼ü£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ŹµŃéÄæµÄ | ŹµŃé²Ł×÷ |
| A | ÅäÖĘŅų°±ČÜŅŗ | Ļņ3mL2%µÄAgNO3ČÜŅŗÖŠµĪČė2µĪ2%µÄ°±Ė® |
| B | ·ÖĄėĢį“漦µ°ĒåÖŠµÄµ°°×ÖŹ | Ļņ¼¦µ°ĒåČÜŅŗÖŠ¼ÓČė“×ĖįĒ¦ČÜŅŗ£¬³ä·ÖÕńµ“ŗó¹żĀĖ£¬½«²»ČÜĪļ¼ÓČėÕōĮóĖ®ÖŠ |
| C | ¼ģŃéÕįĢĒĖ®½āČÜŅŗµÄ»¹ŌŠŌ | Č”2mL 20%µÄÕįĢĒČÜŅŗ£¬¼ÓČėÉŁĮæĻ”ĮņĖį£¬Ė®Ō”ŗóȔɣĮæČÜŅŗ£¬¼ÓČė¼øµĪŠĀÖĘCu£ØOH£©2£¬¼ÓČČ |
| D | ¼ģŃéäåŅŅĶéŌŚNaOHČÜŅŗÖŠŹĒ·ń·¢ÉśĖ®½ā | ½«äåŅŅĶéÓėNaOHČÜŅŗ¹²ČČ£®ĄäČ“ŗó£¬Č”³öÉĻ²ćČÜŅŗ£¬ÓĆĻ”ĻõĖįĖį»Æ£¬¼ÓČėAgNO3ČÜŅŗ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
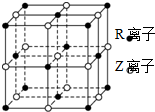 Ō×ÓŠņŹżŠ”ÓŚ36µÄX”¢Y”¢Z”¢W”¢RĪåÖÖŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪŌö“ó£®ĪåÖÖŌŖĖŲÖŠ£¬½öRĪŖ½šŹōŌŖĖŲ£¬ĘäŌ×ÓŠņŹżĪŖ27£®X¼Ūµē×ÓÅŲ¼Ź½ĪŖnsnnpn£¬ŌŖĖŲZ»łĢ¬Ō×Ósµē×Ó×ÜŹżÓėpµē×Ó×ÜŹżĻąµČ£¬WÓėĘäĖüĖÄÖÖŌŖĖŲÄÜ²ćŹż²»Ķ¬£¬ĒŅĪ“³É¶Ōµē×ÓŹżÄæĪŖ1øö£®
Ō×ÓŠņŹżŠ”ÓŚ36µÄX”¢Y”¢Z”¢W”¢RĪåÖÖŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪŌö“ó£®ĪåÖÖŌŖĖŲÖŠ£¬½öRĪŖ½šŹōŌŖĖŲ£¬ĘäŌ×ÓŠņŹżĪŖ27£®X¼Ūµē×ÓÅŲ¼Ź½ĪŖnsnnpn£¬ŌŖĖŲZ»łĢ¬Ō×Ósµē×Ó×ÜŹżÓėpµē×Ó×ÜŹżĻąµČ£¬WÓėĘäĖüĖÄÖÖŌŖĖŲÄÜ²ćŹż²»Ķ¬£¬ĒŅĪ“³É¶Ōµē×ÓŹżÄæĪŖ1øö£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH3CH2CH3ÓėCH4»„ĪŖĶ¬ĻµĪļ | |
| B£® | ŅŅ“¼ŗĶŅŅĖį¶¼ÄÜÓė½šŹōÄĘ·“Ó¦ | |
| C£® | Õż¶”Ķé£ØCH3CH2CH2CH3£©ÓėŅģ¶”Ķé£Ø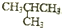 £©»„ĪŖĶ¬·ÖŅģ¹¹Ģå £©»„ĪŖĶ¬·ÖŅģ¹¹Ģå | |
| D£® | ¼×ĶéÓė±½ŌŚæÕĘųÖŠČ¼ÉÕµÄĻÖĻóĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | x=2 | |
| B£® | Fe2+”¢S2O32-¶¼ŹĒ»¹Ō¼Į | |
| C£® | ĮņŌŖĖŲ±»Ńõ»Æ£¬ĢśŌŖĖŲ±»»¹Ō | |
| D£® | ĆæÉś³É1 mol Fe2O4£¬Ōņ×ŖŅʵē×ÓŹżĪŖ3 mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Al£ØOH£©3 | B£® | Fe£ØOH£©3 | C£® | Na2O | D£® | FeCl2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪļÖŹ | CH3OH | CH3OCH3 | H2O |
| ÅضČ/£Ømol•L-1£© | 0.44 | 0.6 | 0.6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
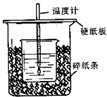 ÓĆ50mL 0.50mol/LŃĪĖįÓė50mL 0.55mol/LNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖćÖŠŗĶČČ£®ŅŃÖŖ±ČČČČŻŹĒ4.18J/£Øg£®”ę£©£®»Ų“šĻĀĮŠĪŹĢā£ŗ
ÓĆ50mL 0.50mol/LŃĪĖįÓė50mL 0.55mol/LNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖćÖŠŗĶČČ£®ŅŃÖŖ±ČČČČŻŹĒ4.18J/£Øg£®”ę£©£®»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com