
| A. | 正极附近c(H+)逐渐增大 | |
| B. | SO42-向正极移动 | |
| C. | 正、负极附近c(H+)基本不变 | |
| D. | Fe片、Cu片同时冒出气泡,则说明Zn片不纯 |
分析 该装置构成原电池,锌易失电子作负极,铜作正极,正极上氢离子得电子发生还原反应,原电池放电时,阳离子向正极移动,阴离子向负极移动.
解答 解:A.该装置中,锌易失电子作负极,负极上锌失电子发生氧化反应生成锌离子,正极上氢离子得电子发生还原反应消耗氢离子,所以附近c(H+)逐渐减小,故A错误;
B.原电池放电时,阴离子向负极移动,所以SO42-向负极移动,故B错误;
C.原电池放电时,正极上氢离子得电子发生还原反应消耗氢离子,所以附近c(H+)逐渐减小,故C错误;
D.电子从锌片流向铜片,所以铜片上有大量电子,氢离子得电子生成氢气,所以氢气在铜片上析出;如果锌片上有氢气生成,则说明锌片不纯,锌与杂质电解质溶液形成原电池,故D正确;
故选D.
点评 本题考查了原电池原理,明确正负极上得失电子及电解质溶液中阴阳离子移动方向即可解答,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧产物只有CO2和H2O | B. | 与溴水发生取代反应 | ||
| C. | 都难溶于水 | D. | 通常不与强酸、强碱、强氧化剂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
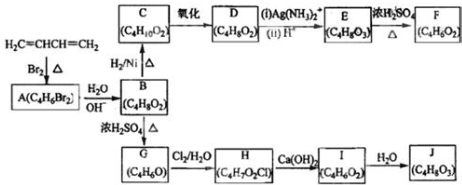
 ;
; +H2O,E中的官能团有羟基、羧基(填名称),与E具有相同官能团的E的同分异构体还有
+H2O,E中的官能团有羟基、羧基(填名称),与E具有相同官能团的E的同分异构体还有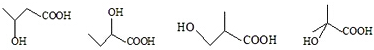 (写出结构简式,不考虑立体结构);
(写出结构简式,不考虑立体结构);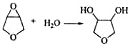 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| B. | 滴定结束后,滴定管尖嘴处有一悬挂液滴 | |
| C. | 取NaOH溶液时先平视读数,后仰视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2次~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com