
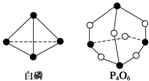
 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )| A. | 吸收1 638 kJ能量 | B. | 放出1 638 kJ能量 | ||
| C. | 吸收126 kJ能量 | D. | 放出126 kJ能量 |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCHCl3的分子数0.1NA | |
| B. | 用惰性电极电解1 L浓度均为2 mol•L-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,理论上阴极析出6.35g金属 | |
| C. | 9.2gNO2和N2O4的混合气中含有的氮原子数为大于0.2NA | |
| D. | VL a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,所有离子浓度均减小 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)前者大 | |
| D. | 0.1mol•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
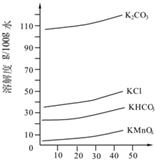 实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下: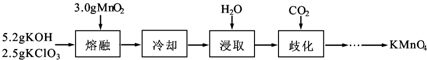
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
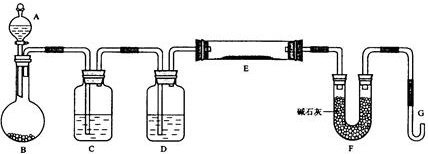
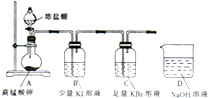 某同学设计如下实验以探究氯、溴、碘的非金属性强弱的递变规律,实验装置如图所示.已知常温下高锰酸钾与浓盐酸混合可产生氯气.
某同学设计如下实验以探究氯、溴、碘的非金属性强弱的递变规律,实验装置如图所示.已知常温下高锰酸钾与浓盐酸混合可产生氯气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该装置能将电能转化为化学能 | B. | 实验过程中铜片逐渐溶解 | ||
| C. | 铁片上会析出红色的铜 | D. | 电子由铁片通过导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都可以使溴水反应褪色 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-,Cl-,Na+,Ba2+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,Cl-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com