
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )

A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
答案 C
解析 结合醋酸与NaOH溶液的反应,pOH、pH的定义及题给图像,分析各选项并得出合理答案。
Q点pOH=pH=a,则有c(H+)=c(OH-),此时溶液呈中性,那么c(CH3COO-)=c(Na+),N点溶液呈碱性,c(OH-)>c(H+),那么c(CH3COO-)<c(Na+),B错;结合图像可知,M点溶液中含有CH3COOH和CH3COONa,在滴加NaOH溶液的过程中,溶液中离子浓度变大,则M点溶液的导电能力比Q点弱,A错;M点pOH=b,N点pH=b,说明M点c(OH-)与N点c(H+)相等,对水的电离抑制程度相同,因此M点和N点水的电离程度相同,C对;若消耗NaOH溶液与醋酸溶液的体积相等,二者恰好反应生成CH3COONa,溶液显碱性,而Q点溶液呈中性,显然醋酸溶液的体积大于消耗NaOH溶液的体积,D错。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
依据反应事实书写热化学方程式
依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同
C.已知:①2H2(g)+O2(g)===2H2O(g) ΔH1=-a kJ·mol-1,②2H2(g)+O2(g)===2H2O(l)
ΔH2=-b kJ·mol-1,则a>b
D.已知:①C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1,②C(金刚石,s)+O2(g)===
CO2(g) ΔH2=-395.0 kJ·mol-1,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11。
(1)该温度下水的离子积常数Kw=______________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=_____________。
②若所得混合液为中性,且a+b=12,则Va∶Vb=__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并______为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL,
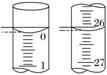
所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
答案 (1)锥形瓶中溶液颜色变化 在半分钟内不变色
(2)D (3)0.00 26.10 26.10
(4)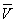 =
=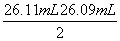 =26.10 mL,c(NaOH)=
=26.10 mL,c(NaOH)=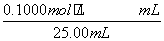 =0.104 4 mol·L-1
=0.104 4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:I2+2S2O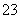 ===S4O
===S4O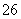 +2I-。
+2I-。
某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是________________________________。
②CuCl2溶液与KI反应的离子方程式为____________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示。下列说法正确的是( )
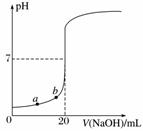
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.010 0 mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL时(忽略反应前后体积变化),该混合液的pH=1+lg 3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对共价键的说法中,不正确的是( )
A.共价键是通过形成共用电子对或原子轨道重叠形成的
B.形成共价键的原子之间电负性相同或相差不大
C.一般情况下一个原子有几个不成对电子就会和几个自旋相反的未成对电子成键
D.共价键是通过共用电子对形成的,不属于电性作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com