

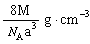 B.
B. 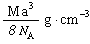
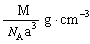 D.
D. 
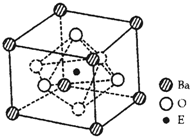
 ),据式量可知,1 mol CsCl的质量为M克,故需求出1mol CsCl的体积。因晶体是由晶胞构成的,而1个CsCl晶胞的体积为a3 cm3。因此,此题解题的关键是找出1 mol CsCl晶体中的晶胞数目,由晶胞的示意图可知,1个晶胞中含1个Cs+和1个Clˉ,所以,在1 mol CsCl晶体中含NA个的晶胞。由此可得,晶体的密度为
),据式量可知,1 mol CsCl的质量为M克,故需求出1mol CsCl的体积。因晶体是由晶胞构成的,而1个CsCl晶胞的体积为a3 cm3。因此,此题解题的关键是找出1 mol CsCl晶体中的晶胞数目,由晶胞的示意图可知,1个晶胞中含1个Cs+和1个Clˉ,所以,在1 mol CsCl晶体中含NA个的晶胞。由此可得,晶体的密度为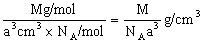 。
。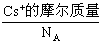 +
+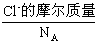 ,即
,即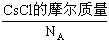 =
=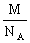 ,因此也可得出晶体的密度。
,因此也可得出晶体的密度。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含有金属元素的晶体不一定是离子晶体 |
| B.CO2和CH4都是由极性键构成的非极性分子 |
| C.HF、HCl、HBr、HI四种物质的沸点依次升高 |
| D.NaHSO4溶于水时既有离子键断裂又有共价键断裂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
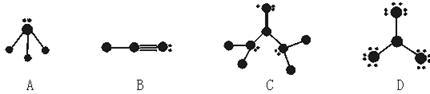
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | X | Y | Z | W | 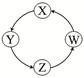 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C6H6、CO2、SiO2 | B.D2O、SO3、NaCl |
| C.C8H10、NH3、H2 | D.H2SO4、P2O5、C3H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com