
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
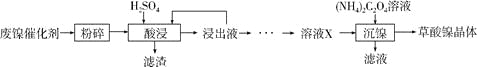
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是____________。
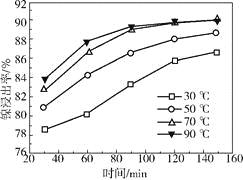
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。
【答案】增大接触面积,加快反应速率;提高镍的浸出率 C 静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成 洗去(NH4)2SO4杂质、便于烘干 防止温度过高,草酸镍晶体失去结晶水或分解 (加适量H2SO4溶液,)加足量H2O2溶液,充分反应后用NaOH溶液调节溶液5.0≤pH<6.7 用NaOH溶液调节“溶液X”的pH≥9.5 除去杂质Ca2+或CaSO4
【解析】
(1)粉碎的目的从速率和限度两个方面回答;
(2)由图中数据可知,从节约能源的角度分析,选择70℃,120min;
(3)继续加沉淀剂,若不再有沉淀生成,则说明已经沉淀完全;
(4)①从为什么要洗和为什么用乙醇洗两个方面考虑;
②温度过高,考虑挥发、分解、水解、氧化等影响;
(5)实验步骤第1步,利用Fe(OH)3和Al(OH)3的Ksp小的特点,先氧化Fe2+为Fe3+,然后调节溶液的PH,将铁、铝元素除去;第2步要除去Ca2+,利用NH4F溶液和Ca2+反应生成CaF2沉淀,充分反应后过滤,得“溶液X”;第3步使Ni2+成为Ni(OH)2沉淀,充分反应后过滤;第4步再把Ni(OH)2转化为NiSO4,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
(1)粉碎的目的是增大接触面积,使反应速率加快,同时提高镍的浸出率;
(2)由图中数据可知,当温度在70-90℃时,时间在120-150min时镍的浸出率最高,从节约能源的角度分析,应该选择70℃,120min,故选择c;
(3)要证明沉镍工序中Ni2+已经沉淀完全,只需将溶液静置,取上层清液,在上层清液中,滴加草酸铵溶液,观察有无沉淀生成,若无沉淀,说明已经沉淀完全;
(4)①用乙醇清洗的目的是洗去固体表面的(NH4)2SO4杂质,同时由于乙醇易挥发,便于烘干固体;
②烘干温度不超过110℃的原因是防止温度过高而使草酸镍晶体失水或者分解;
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,加入适量硫酸和过量的双氧水,使二价铁完全转化为三价铁,再用氢氧化钠溶液调节pH,使Al3+和Fe3+完全沉淀,充分反应后过滤,以除去铁、铝元素; 第2步:由于CaF2的Ksp较小,所以向所得滤液中加入适量NH4F溶液,和溶液中的F-生成CaF2沉淀以除去Ca2+,充分反应后过滤,得“溶液X”;第3步: 用NaOH溶液调节“溶液X”的pH,充分反应后过滤; 第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。其中第2步加入适量NH4F溶液的作用是除去Ca2+或者硫酸钙。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钙能调节人体各系统生理功能,利用如图装置测定碳酸钙型补钙剂中钙的含量。已知氨基磺酸(H2NSO3H)俗称固体硫酸,在水溶液中为一元酸,广泛应用于锅炉水垢的清洗。
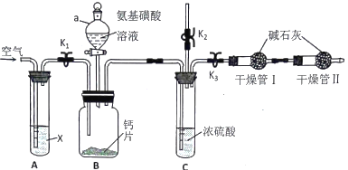
(1)仪器a的名称为____________________。
(2)A装置内X是___________________溶液(填化学式),B 装置内发生反应的化学方程式为____________________________。
(3)组装好仪器后,检查装置的气密性,接下来进行的操作是:打开K1、K2,关闭K3,通空气一段时间,关闭K1、K2,打开K3,打开仪器a活塞,滴入氨基磺酸溶液,待B装置中无气泡产生,关闭仪器a活塞。再次打开K1通空气一段时间,第二次通入空气目的是___________________________。干燥管Ⅱ的作用_________________________。
(4)取某补钙剂样品m克进行测定,测得干燥管Ⅰ在实验前后重量分别为m1克和m2克,则样品中钙的质量分数为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.氨气通入醋酸溶液中 CH3COOH+NH3=CH3COONH4
B.澄清的石灰水跟盐酸反应 H++OH-=H2O
C.碳酸钡溶于醋酸 BaCO3+2H+=Ba2++H2O+CO2↑
D.金属钠跟水反应 2Na+H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是![]()
![]()
A.![]() 葡萄糖和
葡萄糖和![]() 果糖的混合物中羟基数目为
果糖的混合物中羟基数目为![]()
B.标准状况下,![]() 一氟甲烷中H原子数目为
一氟甲烷中H原子数目为![]()
C.![]() 溶液中离子总数大于
溶液中离子总数大于![]()
D.![]() 在稀硫酸作用下水解生成乙醇分子数目为
在稀硫酸作用下水解生成乙醇分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2A(g)+2B(g)![]() C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
0 | 40 | 80 | 120 | 160 | |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
根据表中数据,下列说法正确的是
A.乙容器中的反应温度T<300
B.丙容器中,0-40min内用A的浓度变化表示的平均反应速率为为0.05mol/(L·min)
C.若起始时向甲容器中加入0.2、0.2、0.4和1.2,则反应将向正反应方向进行
D.在0-40min内,提高乙容器中的A的转化率的有效途径是使用高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向物质的量浓度相等的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )
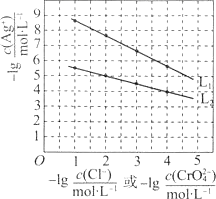
A.Ksp(AgCl)的数量级为10-12
B.L1为Na2CrO4溶液中滴加AgNO3溶液时离子浓度关系曲线
C.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4作指示剂
D.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:ZnS呈白色,CuS呈黑色;常温下,Ksp(ZnS)=3.0×10-25,Ksp(CuS)=1.0×10-36;pM=-lgc(M2+)。常温下,向10.0mL0.20molL-1ZnCl2溶液中逐滴滴加0.10molL-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法不正确的是( )
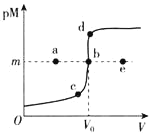
A.V0=20.0mL,m=12.5-![]() lg3
lg3
B.相同实验条件下,若用10.0mL0.20molL-1CuCl2溶液代替上述ZnCl2溶液,则反应终点b向d方向移动
C.若c(ZnCl2)=0.10molL-1,则反应终点可能为e点
D.向b点浊液中加入0.002molCuCl2固体,白色沉淀变黑色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]=6.3×10-31。如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4-](其中M=Al或Cr)。下列说法错误的是( )
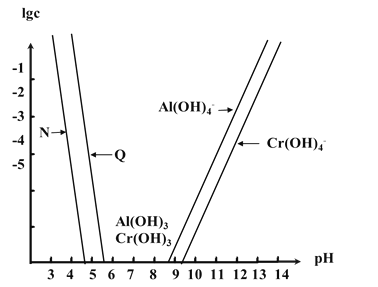
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中![]() ≈4.8×102
≈4.8×102
D.若溶液中Al3+和Cr3+起始浓度均为0.1molL-1,通过调节pH能实现两种元素的分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com