
| A. | 过氧化钠的电子式: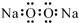 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 乙烯的结构简式为CH2CH2 | D. | 硫原子的结构示意图: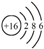 |
分析 A.过氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
B.次氯酸的中心原子为O原子,不存在H-Cl键;
C.乙烯分子中含有碳碳双键,结构简式中应该标出官能团结构;
D.硫原子的核电荷数为16=核外电子总数=16,最外层含有6个电子.
解答 解:A.过氧化钠为离子化合物,化合物中存在钠离子和过氧根离子,过氧化钠的电子式为 ,故A错误;
,故A错误;
B.次氯酸中存在1个H-O键和1个O-Cl键,正确的结构式为:H-O-Cl,故B错误;
C.乙烯分子中含有官能团碳碳双键,其正确的结构简式为:CH2=CH2,故C错误;
D.S原子的核电荷数和核外电子总数都是16,其原子结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及离子结构示意图、电子式、结构简式、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
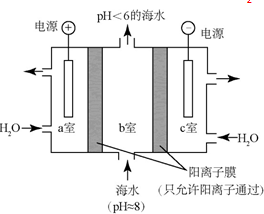
| A. | a室的电极接电源的负极 | |
| B. | 该装置将电能转化为化学能 | |
| C. | c室排出的碱液中含有NaOH | |
| D. | a室的电极反应式为:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该消毒液的pH约为13:ClO-+H2O?HClO+OH- | |
| B. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ MnO4- Na+ Cl- | B. | K+ Na+ NO3- CO32- | ||
| C. | Na+ H+ NO3- SO42- | D. | Fe3+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
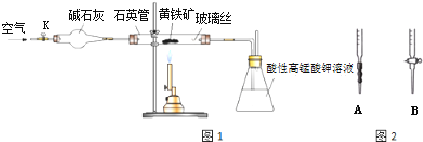
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,溴苯和水,苯酚和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,在选择萃取剂时,要求萃取剂和原溶剂不互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C═C | C-C | C≡C | C-H |
| E/(kJ•mol-1) | 436.0 | 615 | 347.7 | 812 | 413.4 |

 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com