
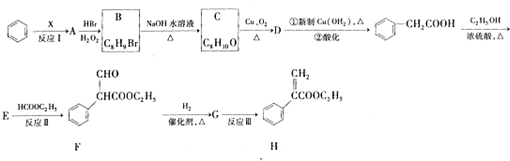
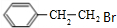 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基和酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基和酯基. .
. 制备
制备 的合成路线
的合成路线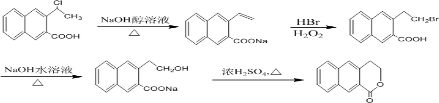 .
. 分析 反应I所涉及的物质均为烃,氢的质量分数均为7.69%,烃A中含氢的质量分数为7.69%,当A的相对分子质量为110时,含有H原子数为:$\frac{110×7.69%}{1}$=8.46,而烃A的相对分子质量小于110,故烃A分子中含H原子个数应大于6而小于8.46,只能为8,A的相对分子量为:$\frac{1×8}{7.69%}$≈104,B分子中含有C原子数为:$\frac{104-8}{12}$=8,所以A的分子式为C8H8,则X为C2H2,X结构简式为CH≡CH,A为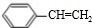 ,A与HBr发生加成反应生成B,根据D与新制Cu(OH )2加热条件下反应,酸化后得苯乙酸,D中含有醛基,则D的结构简式为:
,A与HBr发生加成反应生成B,根据D与新制Cu(OH )2加热条件下反应,酸化后得苯乙酸,D中含有醛基,则D的结构简式为: ;C催化氧化生成E,则C的结构简式为:
;C催化氧化生成E,则C的结构简式为: ;B水解生成C,则B的结构简式为:
;B水解生成C,则B的结构简式为: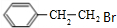 ;苯乙酸与CH3CH2OH在浓硫酸加热条件下,发生酯化反应生成的E,则E的结构简式为
;苯乙酸与CH3CH2OH在浓硫酸加热条件下,发生酯化反应生成的E,则E的结构简式为 ,F与H2加成,醛基转化为羟基,则G的结构简式为:
,F与H2加成,醛基转化为羟基,则G的结构简式为: ,G发生消去反应生成H,由
,G发生消去反应生成H,由 制备
制备 ,可用
,可用 在氢氧化钠醇溶液中发生消去,再在双氧水条件下与溴化氢加成,再碱性水解、酯化可得
在氢氧化钠醇溶液中发生消去,再在双氧水条件下与溴化氢加成,再碱性水解、酯化可得 ,据此进行解答.
,据此进行解答.
解答 解:反应I所涉及的物质均为烃,氢的质量分数均为7.69%,烃A中含氢的质量分数为7.69%,当A的相对分子质量为110时,含有H原子数为:$\frac{110×7.69%}{1}$=8.46,而烃A的相对分子质量小于110,故烃A分子中含H原子个数应大于6而小于8.46,只能为8,A的相对分子量为:$\frac{1×8}{7.69%}$≈104,B分子中含有C原子数为:$\frac{104-8}{12}$=8,所以A的分子式为C8H8,则X为C2H2,X结构简式为CH≡CH,A为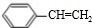 ,A与HBr发生加成反应生成B,根据D与新制Cu(OH )2加热条件下反应,酸化后得苯乙酸,D中含有醛基,则D的结构简式为:
,A与HBr发生加成反应生成B,根据D与新制Cu(OH )2加热条件下反应,酸化后得苯乙酸,D中含有醛基,则D的结构简式为: ;C催化氧化生成E,则C的结构简式为:
;C催化氧化生成E,则C的结构简式为: ;B水解生成C,则B的结构简式为:
;B水解生成C,则B的结构简式为: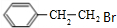 ;苯乙酸与CH3CH2OH在浓硫酸加热条件下,发生酯化反应生成的E,则E的结构简式为
;苯乙酸与CH3CH2OH在浓硫酸加热条件下,发生酯化反应生成的E,则E的结构简式为 ,F与H2加成,醛基转化为羟基,则G的结构简式为:
,F与H2加成,醛基转化为羟基,则G的结构简式为: ,G发生消去反应生成H,
,G发生消去反应生成H,
(1)A为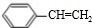 ,A的化学名称为苯乙烯,A分子中最多有3个碳原子在一条直线上,
,A的化学名称为苯乙烯,A分子中最多有3个碳原子在一条直线上,
故答案为:苯乙烯;3;
(2)G的结构简式为  ,对比G与H的结构简式,G中CH2上的1个H原子被-CHO代替,所以反应Ⅱ的反应类型为取代反应;反应Ⅲ为羟基消去生成碳碳双键,所以反应条件是浓H2SO4、加热,
,对比G与H的结构简式,G中CH2上的1个H原子被-CHO代替,所以反应Ⅱ的反应类型为取代反应;反应Ⅲ为羟基消去生成碳碳双键,所以反应条件是浓H2SO4、加热,
故答案为:取代; 浓H2SO4、加热;
(3)根据上面的分析可知,B的结构简式是 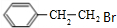 ,E的结构简式为
,E的结构简式为 ,所以E的分子式为C10H12O2,根据F的结构简式可知,F中含氧官能团的名称是醛基和酯基,
,所以E的分子式为C10H12O2,根据F的结构简式可知,F中含氧官能团的名称是醛基和酯基,
故答案为: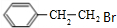 ;C10H12O2;醛基和酯基;
;C10H12O2;醛基和酯基;
(4)C的结构简式为: ,在Cu催化加热条件下,发生催化氧化,生成苯乙醛E,化学方程式为:
,在Cu催化加热条件下,发生催化氧化,生成苯乙醛E,化学方程式为: ,
,
故答案为: ;
;
(5)G( )有多种同分异构体.同时满足下列条件:与FeCl3溶液发生显色反应,含有酚羟基;能发生水解反应和银镜反应,含有甲酸形成的酯基;.苯环上有四个取代基,且苯环上一氯代物只有1种,符合条件的同分异构体有:
)有多种同分异构体.同时满足下列条件:与FeCl3溶液发生显色反应,含有酚羟基;能发生水解反应和银镜反应,含有甲酸形成的酯基;.苯环上有四个取代基,且苯环上一氯代物只有1种,符合条件的同分异构体有: 、
、 、
、 、
、 、
、 、
、 ,总共有6种,
,总共有6种,
故答案为:6;
(6)由 制备
制备 ,可用
,可用 在氢氧化钠醇溶液中发生消去,再在双氧水条件下与溴化氢加成,再碱性水解、酯化可得
在氢氧化钠醇溶液中发生消去,再在双氧水条件下与溴化氢加成,再碱性水解、酯化可得 ,所以合成路线图为:
,所以合成路线图为: ,
,
故答案为: .
.
点评 本题考查有机合成,题目难度中等,试题涉及有机反应类型、同分异构体书写、有机反应方程式等知识,注意根据反应条件进行推断,需要学生熟练掌握官能团的性质与转化,(5)中同分异构体的书写为易错点、难点.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
 分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.
分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
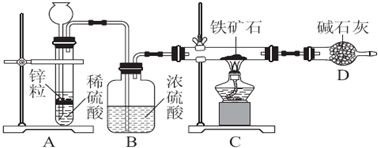
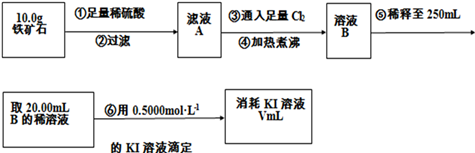
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
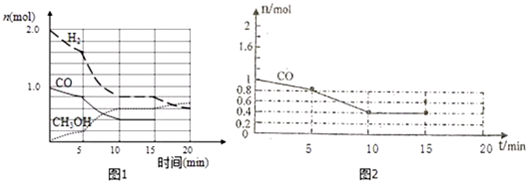
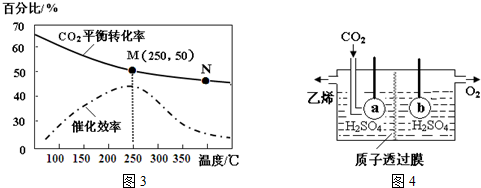
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y位于元素周期表的第2周期第IVA族 | |
| B. | X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X | |
| C. | X、Z、W形成的盐中只含有离子键 | |
| D. | 产生刺激性气味气体的反应离子方程式为H++HSO3-=H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2mol SO3气体通入一定密闭容器中,反应达到平衡后吸收Q kJ热量,则该反应的热化学方程式为 2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ•mol-1 | |
| B. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
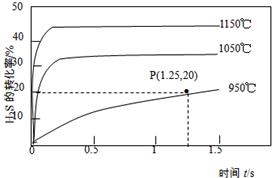 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
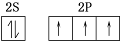 ,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示二氧化碳分子 可以表示二氧化碳分子 | |
| B. | S2-的结构示意图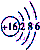 | |
| C. | 电子式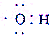 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 光气((COCl2)结构式: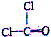 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com