
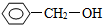 不同类的是( )
不同类的是( )| A. |  | B. | 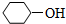 | C. | CH3CH2OH | D. | HOCH3 |
科目:高中化学 来源: 题型:解答题
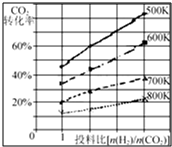 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于K=c2(Z)/[c2(X)•c(Y)],随着反应的进行,Z的浓度不断增大,X,Y的浓度不断减小,平衡常数不断增大 | |
| B. | 当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大 | |
| C. | 可逆反应达到平衡时,逆反应便立即停止了 | |
| D. | 温度发生变化,上述的K值也发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,A2+H2?2HA K=5.6×107 B2+H2?2HB K=43 | 非金属性:A>B |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.0 g重水(D2O)中所含质子数为0.4NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 6.2 g白磷与红磷的混合物中所含磷原子数为0.2NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com