
| A. | 元素X、Y、Z的简单离子具有相同的电子层结构 | |
| B. | W的简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Z两种元素组成的化合物中阴阳离子个数比一定为1:2 | |
| D. | 离子半径:r(Z)<r(Y)<r(X)<r(W) |
分析 短周期主族元素中,Y是迄今发现的非金属性最强的元素,则Y为F元素;X原子的最外层有6个电子,处于VIA族,且原子序数小于F,则X为O元素;W与X属于同一主族,W为S元素;在周期表中Z位于IA族,原子序数大于氟,可知Z为Na,据此结合元素周期律知识解答.
解答 解:短周期主族元素中,Y是迄今发现的非金属性最强的元素,则Y为F元素;X原子的最外层有6个电子,处于VIA族,且原子序数小于F,则X为O元素;W与X属于同一主族,W为S元素;在周期表中Z位于IA族,原子序数大于氟,可知Z为Na,
A.元素X、Y、Z的简单阴离子分别为O2-、F-、Na+,三种离子互为含有10个电子,它们具有相同的电子层结构,故A正确;
B.非金属性F>S,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.X、Z分别为O、Na,二者形成的化合物为氧化钠、过氧化钠,氧化钠和过氧化钠中阴阳离子个数之比都是1:2,故C正确;
D.离子的电子层越大,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径大小为:r(Na+)<r(F-)<r(O2-)<r(S2-),故D正确;
故选B.
点评 本题考查结构性质位置关系应用,正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 | |
| D. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子最外层有8个电子 | |
| B. | 1mol气体氡的质量大约是444g | |
| C. | 该原子中子数是86 | |
| D. | 该原子与同周期ⅠA.ⅡA族阳离子具有相同的核外电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和NaHCO3溶液 | B. | 饱和Ca(HCO3)溶液 | C. | CuSO4稀溶液 | D. | FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
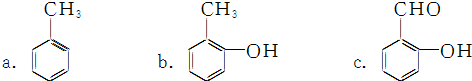
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
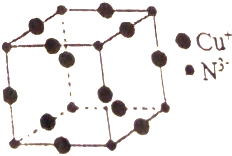 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.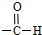 )碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.
)碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.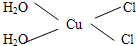 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com