


科目:高中化学 来源: 题型:
| A、铁和稀硫酸反应:Fe+2H+═Fe2++H2↑ |
| B、在NaOH浓溶液中滴入几滴NH4Cl溶液:NH4++OH-=NH3↑+H2O |
| C、常温下氯气与烧碱溶液反应:Cl2+OH-=Cl-+HClO |
| D、Ca(NO3)2溶液中滴加少量的K2CO3溶液:Ca2++CO32-=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
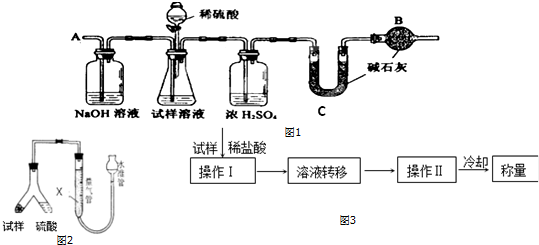
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
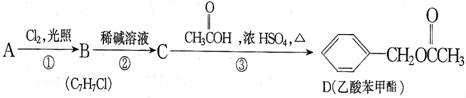
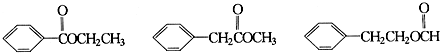
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| PCI3 |
| △ |
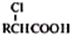 ,写出以苯酚、乙醇和乙酸为原料制备
,写出以苯酚、乙醇和乙酸为原料制备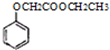 的合成路线流程图(无机试剂任用).合成路线流程图例如下:
的合成路线流程图(无机试剂任用).合成路线流程图例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com