
| A. | Fe2+ | B. | Mg2+ | C. | Al3+ | D. | Fe3+ |
分析 加入过量的氢氧化钠溶液,微热并搅拌,四种离子均反应,铝离子转化为偏铝酸根离子,其余三种离子转化为沉淀,再加盐酸,只发生沉淀与盐酸的反应,以此来解答.
解答 解:加入过量的氢氧化钠溶液,微热并搅拌,四种离子均反应,铝离子转化为偏铝酸根离子,与盐酸反应又生成铝离子,浓度不变,
即镁离子转化为沉淀后,再与盐酸反应生成镁离子,则Mg2+浓度不变,
亚铁离子转化为沉淀后被氧化生成氢氧化铁,与盐酸反应生成铁离子,则Fe2+浓度减小,Fe3+浓度增大,
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的考查,注意亚铁发生的氧化还原反应及滤渣中加盐酸,题目难度不大.


科目:高中化学 来源: 题型:解答题
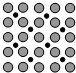 ①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | C | C. | KNO3、S | D. | N2、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
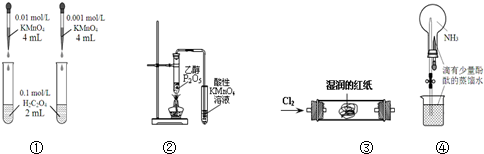
| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由“HF比HCl稳定性好”,可推知HF比HCl沸点高 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 由“相同条件下,HF比HCl溶液的酸性弱”,可推知氟的非金属性小于氯的非金属性 | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com