
| A、H+、K+、OH- |
| B、H+、Cl-、CO32- |
| C、Ba+、Na+、SO42- |
| D、Na+、Cu2+、Cl- |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
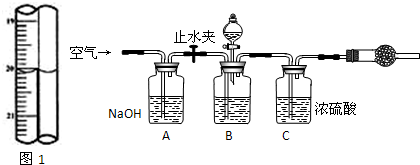
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 -CH=CH2)的叙述错误的是( )
-CH=CH2)的叙述错误的是( )| A、可以和溴水反应 |
| B、是苯的同系物 |
| C、分子中有4个碳碳双键 |
| D、1mol苯乙烯可以和4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
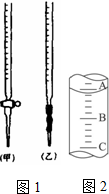 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B、锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C、滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D、滴定前读数正确,达到滴定终点后,俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com