
分析 (1)丁同学实验中镁易失电子作负极、Al作正极,负极上镁发生氧化反应;戊同学实验中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(2)根据作负极的金属活泼性强结合电池中的负极判断;
(3)因为镁与NaOH溶液不反应,铝与NaOH溶液能反应,故将镁和铝用导线连接后放入NaOH溶液中,负极失去电子为铝;而镁、铝均能与稀硫酸反应,由于镁失去电子的能力比铝强,负极失去电子为镁.
解答 解:(1)丁同学实验中镁易失电子作负极、Al作正极,负极上镁发生氧化反应,负极反应为Mg-2e-=Mg2+;
戊同学实验中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为Al+4OH--3e-=AlO2-+2H2O;
故答案为:Mg-2e-=Mg2+;Al+4OH--3e-=AlO2-+2H2O;
(2)丁同学实验中镁作负极、戊同学实验中铝作负极,根据作负极的金属活泼性强判断,戊同学实验中铝活动性强,故答案为:Al;
(3)因为镁与NaOH溶液不反应,铝与NaOH溶液能反应,故将镁和铝用导线连接后放入NaOH溶液中,负极失去电子为铝;而镁、铝均能与稀硫酸反应,由于镁失去电子的能力比铝强,负极失去电子为镁.所以金属活动性:Mg>Al,
故答案为:镁与NaOH溶液不反应,铝与NaOH溶液能反应,故将镁和铝用导线连接后放入NaOH溶液中,负极失去电子为铝;而镁、铝均能与稀硫酸反应,由于镁失去电子的能力比铝强,负极失去电子为镁.金属活动性:Mg>Al.
点评 本题考查金属活泼性及探究原电池原理,为高频考点,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极为易错点,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同素异形体 | B. | 质量数为31的磷原子:${\;}_{15}^{31}$P | ||
| C. | 次氯酸的电子式: | D. | 乙烯的结构简式是:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 | |
| C. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 同主族金属元素从上到下,最高价氧化物对应水化物酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是( )
25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是( )| A. | 根据图示可计算出Ksp(Ag2CO3)=9×10-9 | |
| B. | 向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点 | |
| C. | 反应Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108 | |
| D. | 在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、玻璃、水泥都是硅酸盐产品 | |
| B. | 水晶、玛瑙、光纤、硅胶的主要成分都是SiO2 | |
| C. | SiO2很稳定,与所有的酸都不反应 | |
| D. | 单质硅是制作光导纤维的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
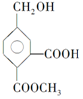 ,它在一定条件下可发生的反应为( )
,它在一定条件下可发生的反应为( )| A. | ①②④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol氦气所含的原子数为2NA | |
| B. | 1.8g NH4+离子中所含的电子数为1.1NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为4NA | |
| D. | NA个氮分子和NA个氢分子的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2Z(g)反应每消耗1molY放出akJ的热量,现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡时,放出热量ckJ,且,则a、b、c的值或关系正确的是( )
2Z(g)反应每消耗1molY放出akJ的热量,现有甲、乙两容积相等且固定的密闭容器,在保持该温度恒定的条件下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡时,放出热量ckJ,且,则a、b、c的值或关系正确的是( )| A. | 2b=c | B. | a=b | C. | a>2c | D. | 以上都不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com