
| A�� | �� | B�� | �� | C�� | �� | D�� | �� |
���� ��ͬ���ʱ�ʾ������֮�ȵ����仯ѧ������֮�ȣ��ʲ�ͬ���ʱ�ʾ���������仯ѧ�������ı�ֵԽ��ʾ�ķ�Ӧ����Խ�죬ע�ⵥλ����һ�£�
��� �⣺��ͬ���ʱ�ʾ������֮�ȵ����仯ѧ������֮�ȣ��ʲ�ͬ���ʱ�ʾ���������仯ѧ�������ı�ֵԽ��ʾ�ķ�Ӧ����Խ�죮
��.$\frac{v��A��}{3}$=0.2mol•L-1•min-1��
��.$\frac{v��B��}{1}$=0.5mol•L-1•min-1��
��.$\frac{v��C��}{2}$=0.05mol•L-1•s-1=3mol•L-1•min-1��
��.$\frac{v��D��}{2}$=0.225mol•L-1•min-1��
�ʷ�Ӧ����v��C����v��B����v��D����v��A����
��ѡ��A��
���� ���⿼�黯ѧ��Ӧ���ʿ����Ƚϣ�Ҳ����ת��Ϊͬһ���ʱ�ʾ�����ʽ��бȽϣ�ע�Ᵽ�ֵ�λһ�£�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ұ����������$��_{Na_{3}AlF_{6}}^{���}$Al | |
| B�� | �����������$��_{����}^{����}$SO2$\stackrel{H_{2}O}{��}$H2SO3$\stackrel{O_{2}}{��}$H2SO4 | |
| C�� | ��NaCl��Ư�ۣ�NaCl��aq��$\stackrel{���}{��}$Cl2$\stackrel{ʯ����}{��}$Ư�� | |
| D�� | �ϳɰ���NH4Cl��Ca��OH��2����$\stackrel{��}{��}$NH3$\stackrel{��ʯ��}{��}$��������İ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 Bλ�����ڱ��еڶ����ڢ�A�壮
Bλ�����ڱ��еڶ����ڢ�A�壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O�ڸ�����Ҳ�ѷֽ� | |
| B�� | F2��Cl2��Br2��I2���ʵ��۵��������� | |
| C�� | SiH4���۵����CH4���۵� | |
| D�� | NH3�ķе����PH3�ķе� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼװ���У�U�ι���Ϊ��īˮ��a��b�Թ��ڷֱ�ʢ�� �������Եģ�ʳ��ˮ�ͣ������Եģ��Ȼ����Һ����������������C��Fe���飬a��b�о��ܹ���ԭ��ض�ʹ���ֱ�O2��H+ ��ʴ������һ��ʱ�䣮�����й�����������ǣ�������
��ͼװ���У�U�ι���Ϊ��īˮ��a��b�Թ��ڷֱ�ʢ�� �������Եģ�ʳ��ˮ�ͣ������Եģ��Ȼ����Һ����������������C��Fe���飬a��b�о��ܹ���ԭ��ض�ʹ���ֱ�O2��H+ ��ʴ������һ��ʱ�䣮�����й�����������ǣ�������| A�� | �������е�̼��ԭ��ص����� | |
| B�� | ��īˮ�����ߵ�Һ���Ϊ����Ҹ� | |
| C�� | ���Թ�����ͬ�ĵ缫��Ӧʽ�ǣ�Fe-2e-�TFe2+ | |
| D�� | a�Թ���O2�õ��ӣ�b�Թ���H+ �õ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�� | ���ʻ�ṹ��Ϣ |
| A | �����Ƴɵĸ�ѹ�ƣ������Ļƹ�����ǿ�����Զ�����䵥��ȼ�պ����ɵ���ɫ���� |
| B | ��ҵ��ͨ������Һ̬��������䵥�ʣ�ԭ�ӵ��������������ڲ����������2.5�� |
| C | ������˫ԭ�ӷ��ӣ����¡���ѹ���ǵ�����ɫ���壬ԭ�ӵ�L��������һ�����Ӽ��ﵽ�ȶ��ṹ |
| D | +2�������ӵĺ�������Ų�����ԭ����ͬ |
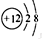 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪2H2��g��+O2��g��=2H2O��g������H=-483.6 kJ•mol-1����������ȼ����Ϊ241.8kJ•mol-1 | |
| B�� | ��֪C��ʯī��s��=C�����ʯ��s������H��0������ʯ��ʯī�ȶ� | |
| C�� | ��֪NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l������H=-57.4kJ•mol-1����20.0g���ʵ�NaOHϡ��Һ��ϡ������ȫ�кͣ��ų�������С��28.7kJ | |
| D�� | ��֪��2C��s��+2O2��g��=2CO2��g����H1��2C��s��+O2��g��=2CO��g����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol̼��1 molˮ������Ӧ����1 mol CO��1 mol H2��ͬʱ����131.3 kJ���� | |
| B�� | 1 mol̼��1 molˮ��Ӧ����1 molCO�� 1 mol H2��ͬʱ�ų�131.3 kJ���� | |
| C�� | ����̼��ˮ������Ӧ����131.3 kJ���� | |
| D�� | 1��̼ԭ�Ӻ�1��ˮ���ӷ�Ӧ������131.1 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com