
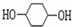
 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答
 .
. ,F
,F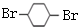 .
. ,
, .
. 分析 根据苯酚的性质可知,与氢气发生加成反应生成A为 ,
, 在浓硫酸作用下发生消去反应生成B为
在浓硫酸作用下发生消去反应生成B为 ,进而与溴发生加成反应生成C为
,进而与溴发生加成反应生成C为 ,C在NaOH乙醇溶液的作用下发生消去反应生成D为
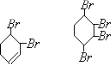
,C在NaOH乙醇溶液的作用下发生消去反应生成D为 ,D与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,由G可知应为1,4加成产物,则E为
,D与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,由G可知应为1,4加成产物,则E为 ,F为
,F为 ,最后水解可生成G,结合有机物的结构和性质解答该题.
,最后水解可生成G,结合有机物的结构和性质解答该题.
解答 解:根据苯酚的性质可知,与氢气发生加成反应生成A为 ,
, 在浓硫酸作用下发生消去反应生成B为
在浓硫酸作用下发生消去反应生成B为 ,进而与溴发生加成反应生成C为
,进而与溴发生加成反应生成C为 ,C在NaOH乙醇溶液的作用下发生消去反应生成D为
,C在NaOH乙醇溶液的作用下发生消去反应生成D为 ,D与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,由G可知应为1,4加成产物,则E为
,D与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,由G可知应为1,4加成产物,则E为 ,F为
,F为 ,最后水解可生成G,
,最后水解可生成G,
(1)A为 ,属于醇,鉴别A与苯酚的方法是在两种试剂中分别加入浓溴水,若有白色沉淀生成的,原物质为苯酚,没有沉淀的为
,属于醇,鉴别A与苯酚的方法是在两种试剂中分别加入浓溴水,若有白色沉淀生成的,原物质为苯酚,没有沉淀的为 ,
,
故答案为:分别加入浓溴水,若有白色沉淀生成的,原物质为苯酚,没有沉淀的为 ;
;
(2)由以上分析可知B为 ,F为
,F为 ,故答案为:
,故答案为: ;
; ;
;
(3)反应④为 在NaOH乙醇溶液的作用下发生消去反应生成
在NaOH乙醇溶液的作用下发生消去反应生成 ,方程式为
,方程式为 ,
,
故答案为: ;
;
(4)D为 ,与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,对应的副产品为
,与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,对应的副产品为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,题目难度不大,解答本题的关键是根据苯酚能发生加成反应的性质进行推断.


科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写可能正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Na+、Fe3+、Cl-、I- | NaOH溶液 | Fe3++3OH-=Fe(OH)3↓ |
B | Mg2+、HCO | 过量NaOH溶液 | Mg2++HCO H2O+Mg(OH)2↓+CO |
C | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2=CO |
D | Na+、NO | NaHSO4溶液 | SO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 降低温度,正反应速率减小,而逆反应速率增大 | |
| C. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g | |
| D. | 达到平衡时,SO2的转化率是90% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol KClO3 | B. | 0.5mol H3PO4 | C. | 1mol O2 | D. | 3.01×1023个CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2.0 mol/L 的盐酸与100 mL 2.0 mol/L 的醋酸溶液中氢离子个数均为0.2×6.02×1023 | |
| B. | 每摩尔烷烃(CnH2n+2)含有的共价键数目为(3n+1)×6.02×1023 | |
| C. | 标准状况下,11.2 L四氯化碳所含分子数为0.5×6.02×1023 | |
| D. | 24g镁在足量CO2中燃烧转移的电子数目为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Z和氢三种元素形成的化合物中只有共价键 | |
| C. | 原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Z) | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧反应一定是放热反应 | |
| B. | 反应物总能量大于生成物总能量 | |
| C. | 反应物键能总和大于生成物键能总和 | |
| D. | 是体系将储存的能量释放出来的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com