
某同学帮助水质检测站配制1000mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择___________mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。
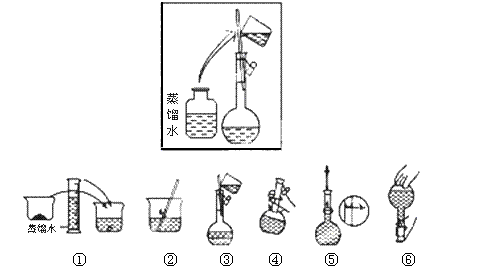 |
A.②与③ B.①与② C.④与⑤
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。
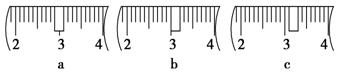
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会 ;
②转移溶液过程中,少量液体溅出来,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 (填“大”或“小”)。
【答案】
(1)1000; (2)C;
(3)40.0; c;
(4)①偏大 ②偏小 ③无影响 ④无影响
(5)NaOH易潮解、易吸收空气中的CO2而变质(答出一点即可); 小 ;
【解析】
(1)配制1000mL 1 mol·L-1NaOH溶液,选择1000mL的容量瓶。
(2)放在④与⑤之间
(3)用托盘天平称取NaOH固体40.0g
(4)①定容时,俯视读数,浓度会偏大;
②转移溶液过程中,少量液体溅出来,浓度会偏小;
③容量瓶未干燥,浓度无影响;
④定容摇匀后发现溶液凹面低于刻度线,浓度无影响
(5)配制溶液的实际操作过程中,动作要快,否则由于NaOH易潮解、易吸收空气中的CO2而变质;会使配制的NaOH溶液的浓度比1 mol·L-1小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将乙炔和一种气态单烯烃组成的混合气体1L,与11L氧气混合,点燃完全反应后,得到气体12L(气体体积均在1.01×105Pa、1200C的条件下测定)。则该混合气体中的单烯烃可能是什么?两种成分的体积比为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在加热时,浓硫酸与铜发生反应的化学方程式为:
2H2SO4(浓)+Cu  CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
A.是氧化还原反应 B.铜是还原剂
C.H2SO4表现了氧化性和酸性 D.反应后铜元素的化合价降低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的量浓度表述正确的是
A.0.2 mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6 mol
B.50mL 2 mol·L-1的NaCl溶液和100mL 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1 L水吸收22.4 L氯化氢(标况下)所得盐酸的浓度是1 mol·L-1
D.10 g 98%的硫酸(密度为1.84g · cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。
已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-发生转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是元素周期表前四周期的一部分,关于元素R、W、X、Y、Z的叙述正确的是( )
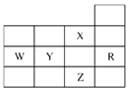
A.最高价氧化物的水化物的酸性:W>Y
B.Z的单质常温下是液体,所在的周期中含有32种元素
C.Z的原子序数比R大17
D.氢化物的沸点:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)
 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
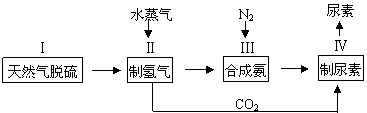 |
(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)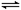 CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)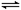 CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是 。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为
。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式
_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为H2N-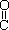 -NH2,请写出尿素的同分异构体中含有离子键的化学式 。
-NH2,请写出尿素的同分异构体中含有离子键的化学式 。
(5)已知CO2+ 2NH3  CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com