
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式;氢氧化钡是强碱完全电离,硫酸是强酸,完全电离,硫氢化钠、亚硫酸钠是盐,是强电解质完全电离,一水合氨、碳酸属于弱酸存在电离平衡,据此进行分析解答.
解答 解:(1)氢氧化钡是强电解质,是由氢氧根离子和钡离子构成,能完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,
故答案为:Ba(OH)2=Ba2++2OH-;
(2)硫酸是强电解质,能完全电离,电离方程式为:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(3)NH3•H2O是弱电解质部分电离,电离过程可逆,电离方程式为:NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(4)H2CO3是弱酸为弱电解质,分步电离,电离过程可逆,电离方程式为:H2CO3?HCO3-+H+,HCO3-?H++CO32-,
故答案为:H2CO3?HCO3-+H+,HCO3-?H++CO32-;
(5)NaHS是强碱弱酸盐,属于强电解质完全电离,HS-离子部分电离,电离方程式为:NaHS=Na++HS-,HS-?H++S2-,
故答案为:NaHS=Na++HS-;HS-?H++S2-;
(6)NaHSO3是强碱弱酸盐,属于强电解质完全电离,HSO3-离子部分电离,电离方程式为:NaHSO3=Na++HSO3-,HSO3-?H++SO32-,
故答案为:NaHSO3=Na++HSO3-,HSO3-?H++SO32-..
点评 本题考查了电离方程式的书写,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 从物质的分类角度来看,油条配方中的“明矾、碱”均属于盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为:3CO32-+2KAl(SO4)2•12H2O═3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | 3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
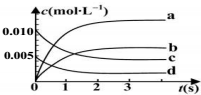 在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示丙烯的键线式 表示丙烯的键线式 | B. |  表示甲烷分子球棍模型 表示甲烷分子球棍模型 | ||
| C. | C2H4O2表示乙酸的分子式 | D. |  34S2-的结构示意图 34S2-的结构示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com