
材料的不断发展可以促进社会进步.
①“玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金,选用镁铝合金的优点是 、、 (任答一点).
②碳化硅硬度很大,它属于 (填字母).
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 .

| 合金的概念及其重要应用;无机非金属材料;乙烯的化学性质. | |
| 专题: | 化学应用. |
| 分析: | (1)合金的硬度大、熔点低; (2)碳化硅为非金属元素形成的化合物,为无机物; (3)乙烯含有碳碳双键,可发生加聚反应生成聚乙烯. |
| 解答: | 解:(1)合金的硬度大、密度小、熔点低,耐腐蚀,故答案为:密度小、强度大、耐腐蚀; (2)碳化硅是无机非金属材料,故答案为:b; (3)聚乙烯塑料可用来包装食品,CH2=CH2含有C=C,可发生加聚反应,反应的方程式为 故答案为: |
| 点评: | 本题考查合金、聚乙烯等知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大. |


科目:高中化学 来源: 题型:
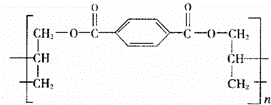
某种高分子化合物的结构简式如图所示:合成它的单位可能有:①对苯二甲酸,②对苯二甲酸甲酯,③丙烯醇,④丙烯,⑤乙烯.
其中正确的一组是( )
|
| A. | ①② | B. | ④⑤ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
分析如图所示的四个原电池装置,结论正确的是( )
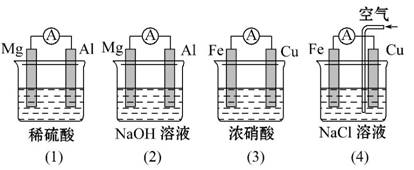
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-====6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-====Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e-====H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 稀硝酸与氢氧化钾溶液反应:H++OH一═H2O |
|
| B. | 铝与稀盐酸反应:Al+2H+═Al3++H2↑ |
|
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH一═Fe(OH)3↓+3Cl﹣ |
|
| D. | 二氧化碳与石灰水反应:CO2+2OH一═CO32一+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于甲、乙、丙、丁四个图象的说法中,正确的是( )
|
| A. |
是等质量的两份锌粉a、b分别加到过量的稀硫酸中,同时向a中加入少量CH3COONa溶液,产生H2的体积V(L)与时间t(min)的关系图 |
|
| B. |
足量CO2不断通入含KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的体积的关系图 |
|
| C. |
由图可知,双氧水在有催化剂存在时的热化学方程式为:2H2O2(l)=2H2O(l)+O2(g)△H=﹣2(Ea2′﹣Ea2) kJ•mol﹣1 |
|
| D. |
装置图能实现铁上镀锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
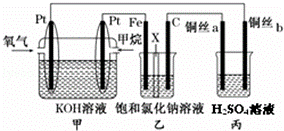
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜. 请按要求回答相关问题:
(1)甲烷燃料电池正极反应式为 .
(2)石墨电极(C)的电极反应式为 .
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为 L.
(4)丙中两根铜丝电极的质量均为64g,电解质为500mL 0.1mol•L﹣1H2SO4溶液.电解一段时间后,a端收集到1.12L气体(标准状况下),取出电极,对电极进行干燥并称重,测得b电极的质量减少6.4g.求此时所得溶液的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
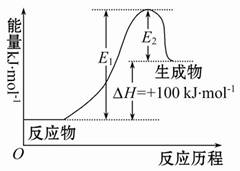
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不小于100 kJ·mol-1
D.正反应活化能比逆反应活化能大100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①CH4(g)+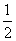 O2(g)====CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
O2(g)====CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
②CH4(g)+H2O(g)====CO(g)+3H2(g) ΔH2=+216 kJ·mol-1
(1)氢气与氧气反应生成水蒸气的热化学方程式为
___________________________________________________________________。
(2)现有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。
①若x=0.2,反应①放出的能量为________ kJ。
②若x=0.5,反应①与②______(填“放出”或“吸收”)的总能量为_____kJ。
③若x=________时,反应①与②放出(或吸收)的总能量为0。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com