
【题目】为防止Fe2+被空气中O2氧化,需要加入( )
A.碳粉B.硫粉C.银粉D.铁粉
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g) ![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO),无色气体,易溶于水,有特殊的刺微气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制Cu(OH)2反应的产物成分,进行如下研究:
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5 mol·L-1 NaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。

①仪器b的名称是____________。
②仪器c的作用为____________。
③能说明甲醛具有还原性的实验现象是____________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。

①依次连接的合理顺序为:A→B→_____→_____→_____→_____→G,________
②装置B的作用是_______________。
③确认气体产物中含H2而不含CO的现象是_________________________。
(3)已知:![]() 。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);

已知:ⅰ.Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) ![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
ⅱ.2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
通过上述实验,可以得出红色固体产物主要是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 甲烷分子中5个原子在同一平面内B. 乙烷分子中所有原子不都在同一平面内
C. 苯分子为平面正六边形结构D. 聚乙烯分子是由结构单元重复组成的高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是三种短周期主族元素。甲是一种常见的温室气体,A、B、C原子序数之和为26,它们之间存在如图所示关系。下列说法正确的是

A. 简单气态氢化物的稳定性:C > B
B. 原子半径大小: C > B > A
C. 与甲含相同元素的另一化合物只含非极性键
D. 工业上常用电解熔融乙物质来制取A的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
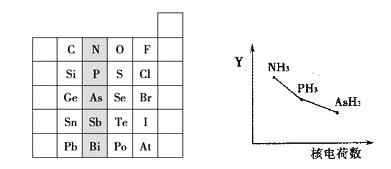
⑴ 阴影部分元素的外围电子排布式的通式为_________。Sb的元素名称为________。基态P原子中,电子占据的最高能级符号为______,该能层具有的原子轨道数为______。
⑵ 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如上右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
A.稳定性B.沸点C.R—H键能D.分子间作用力
⑶ 某种新型储氧材料的理论结构模型如下左图所示,图中虚线框内碳原子的杂化轨道类型有____________种。

⑷ CN-和Fe2+、Fe3+及K+能形成一种蓝色配位化合物普鲁士蓝。上右图是该物质的的结构单元(K+未标出),该图是普鲁士蓝的晶胞吗?_______ (填“是”或“不是”),平均每个晶胞中含有______个K+。

⑸磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是{SiO4}四面体,多磷酸盐中是{PO4}四面体。右图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )

A. 钠悬浮在煤油层中
B. 钠静止在两液面之间
C. 钠沉入水底下
D. 钠在两液体界面附近上下跳动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1mol/|LCH3COONa 与0.lmol/LHCl 溶液等体积混合: c(Na+)=c(Cl-)>c(OH-)>cCH3COO-)
B. 0.lmol/LNH4Cl与0.lmol/L 氨水等体积浪合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1mol/LNa2CO3与0.lmol/LNaHCO3溶液等体积混合:2/3c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D. 0.1mol/LNa2C2O4与0.lmol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com