
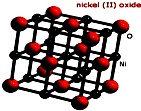
 在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇.
在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇.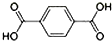 )、4,4’-联吡啶[
)、4,4’-联吡啶[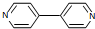 (可简化为
(可简化为 )]等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:
)]等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图: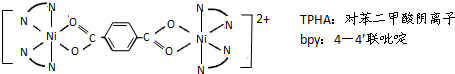
| 0.94 |
| 0.04 |
| 47 |
| 2 |
| 47 |
| 2 |
| 7+1 |
| 2 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
| A、O2和O3互为同素异形体 |
| B、CH3CH3和CH3 CH2CH3互为同系物 |
| C、CH3CH2OH和CH3OCH3互为同分异构体 |
| D、CH3COOCH3和HCOOCH2CH3为同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
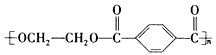 .现以煤的干馏产品A与F为原料制备PET,生产流程如图所示.其中A为烃,含碳元素的质量分数为90.6%,其蒸气的密度是空气密度的3.66倍,能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.M分子里所有原子共平面.
.现以煤的干馏产品A与F为原料制备PET,生产流程如图所示.其中A为烃,含碳元素的质量分数为90.6%,其蒸气的密度是空气密度的3.66倍,能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.M分子里所有原子共平面.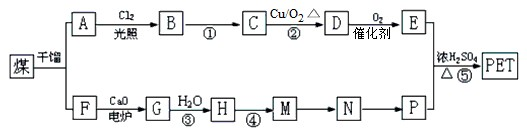
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠加入盐酸:2O22-+4H+=2H2O+O2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ |
| C、AlCl3溶液中滴入氨水:Al3++3OH-=Al(OH)3↓ |
| D、Al(OH)3中滴加盐酸:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com