
| A. | NaHCO3溶液 | B. | KNO3溶液 | C. | 稀醋酸 | D. | Na2SO4溶液 |
科目:高中化学 来源: 题型:选择题
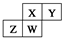 .四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
.四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnC2水解生成乙烷 | B. | Al4C3水解生成丙炔 | ||
| C. | Mg2C3水解生成丙炔 | D. | Li2C2水解生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{H_{2}SO_{4}}{→}$Cu | B. | Cu$\stackrel{CuSO_{4}}{→}$Ag | C. | Zn$\stackrel{NH_{4}Cl}{→}$C | D. | Zn$\stackrel{C_{2}H_{5}OH}{→}$Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
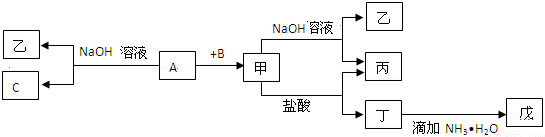
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com