
| A. | 向NaSiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| B. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
分析 A.反应生成硅酸沉淀和亚硫酸氢钠;
B.反应生成硝酸铁、NO和水;
C.水解分别进行,以第一步为主;
D.遵循电子和电荷守恒.
解答 解:A.向NaSiO3溶液中通入过量SO2的离子反应为SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3-,故A错误;
B.向稀硝酸中加入少量铁粉的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,故B错误;
C.碳酸钠的水解的离子反应为CO32-+H2O?HCO3-+OH-,故C错误;
D.氢氧化铁溶于氢碘酸的离子反应为2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液 | B. | 通入二氧化碳 | C. | 氢氧化钙溶液 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2、NO、O2 | B. | 肯定没有C12、O2和NO2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
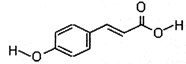
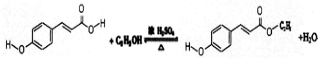 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
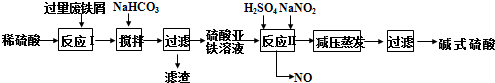
 [Fe2(OH)4]2++2H+.
[Fe2(OH)4]2++2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 石英可用于制作光导纤维,光导纤维遇强碱会“断路” | |
| C. | 清晨阳光穿过林木枝叶铺洒地面属于丁达尔现象 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com