
体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述不正确的是
A.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
B.两种溶液的物质的量浓度不相同
C.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
D.它们分别与足量CaCO3反应时,放出的CO2一样多
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
25℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1 的体积比混合,若混合溶液中c(NH )=c(Cl-),则溶液的pH
)=c(Cl-),则溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是 ( )
A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多
B.盐酸和醋酸都可用相应的钠盐和浓硫酸反应制取
C.0.1mol·L-1醋酸钠溶液的pH>7
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
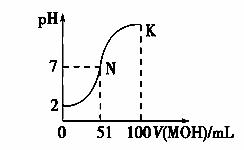
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①②③ B.①②③⑤ C.②⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下2HBr(g) H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
A.升高温度 B.缩小体积 C.减小压强 D. 增大H2浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g)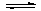 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C三种化合物,各取40 g相混合,完全反应后,得到18 g B、49 g C,还有D生成。已知D的相对分子质量为106。现将22 g A和11 g B反应,能生成D的物质的量是( )
A.1 mol B.0.5 mol
C.0.275 mol D.0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按下述操作配制500 mL 0.2 mol·L-1Na2SO4溶液,请回答有关问题。
| 实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为________g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:________________ |
| ③将Na2SO4加入100 mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施?________________________________________________________________________ |
| ④将烧杯中溶液转移至500 mL容量瓶中 | 为了防止溶液溅出,应采取什么措施?________________________________________________________________________ |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1~2 cm处应如何操作?________________________________________________________________________ |
(1)上述实验中使用容量瓶前应_______________________________。
(2)取出该Na2SO4溶液10 mL加水稀释到100 mL,稀释后溶液中Na+的物质的量浓度是________。
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需________。
(4)在实验中,以下操作对实验结果没有影响的是________。
A.没有将洗涤液转移到容量瓶中
B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com